ഒരു രാസപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കം. രാസപ്രവർത്തനങ്ങളുടെ സന്തുലിത സ്ഥിരാങ്കങ്ങളുടെ നിർണ്ണയവും രാസ സന്തുലിതാവസ്ഥയുടെ കണക്കുകൂട്ടലും
സ്ഥിരമായ രാസ സന്തുലിതാവസ്ഥ
എല്ലാ രാസപ്രവർത്തനങ്ങളെയും 2 ഗ്രൂപ്പുകളായി തിരിക്കാം: മാറ്റാനാവാത്ത പ്രതിപ്രവർത്തനങ്ങൾ, അതായത്. പ്രതിപ്രവർത്തിക്കുന്ന പദാർത്ഥങ്ങളിൽ ഒന്ന് പൂർണ്ണമായും ദഹിപ്പിക്കപ്പെടുന്നതുവരെ തുടരുന്നു, കൂടാതെ പ്രതിപ്രവർത്തിക്കുന്ന പദാർത്ഥങ്ങളൊന്നും പൂർണ്ണമായും ദഹിക്കാത്ത റിവേഴ്സിബിൾ പ്രതികരണങ്ങൾ. മാറ്റാനാകാത്ത പ്രതികരണം ഒരു ദിശയിൽ മാത്രമേ സംഭവിക്കുന്നുള്ളൂ എന്നതാണ് ഇതിന് കാരണം. ഒരു വിപരീത പ്രതികരണം നേരിട്ടും സംഭവിക്കാം വിപരീത ദിശ. ഉദാഹരണത്തിന്, പ്രതികരണം
Zn + H 2 SO 4 ® ZnSO 4 + H 2
സൾഫ്യൂറിക് ആസിഡിൻ്റെയോ സിങ്കിൻ്റെയോ പൂർണ്ണമായ അപ്രത്യക്ഷമാകുന്നതുവരെ തുടരുകയും വിപരീത ദിശയിലേക്ക് ഒഴുകാതിരിക്കുകയും ചെയ്യുന്നു: സിങ്ക് സൾഫേറ്റിൻ്റെ ജലീയ ലായനിയിലേക്ക് ഹൈഡ്രജനെ കടത്തിവിട്ട് ലോഹ സിങ്കും സൾഫ്യൂറിക് ആസിഡും ലഭിക്കില്ല. അതിനാൽ, ഈ പ്രതികരണം മാറ്റാനാവാത്തതാണ്.
ക്ലാസിക് ഉദാഹരണംനൈട്രജൻ, ഹൈഡ്രജൻ എന്നിവയിൽ നിന്നുള്ള അമോണിയയുടെ സമന്വയമാണ് ഒരു റിവേഴ്സിബിൾ പ്രതികരണം: N 2 + 3 H 2 ⇆ 2 NH 3 .
നിങ്ങൾ ഉയർന്ന താപനിലയിൽ 1 മോൾ നൈട്രജനും 3 മോൾ ഹൈഡ്രജനും കലർത്തുകയാണെങ്കിൽ, മതിയായ പ്രതികരണ സമയത്തിന് ശേഷവും, പ്രതികരണ ഉൽപ്പന്നം (NH 3) മാത്രമല്ല, പ്രതികരിക്കാത്ത ആരംഭ പദാർത്ഥങ്ങളും (N 2, H 2) റിയാക്ടറിൽ ഉണ്ടായിരിക്കും. അതേ അവസ്ഥയിൽ, നൈട്രജൻ്റെയും ഹൈഡ്രജൻ്റെയും മിശ്രിതമല്ല, ശുദ്ധമായ അമോണിയയാണ് റിയാക്ടറിലേക്ക് അവതരിപ്പിക്കുന്നതെങ്കിൽ, കുറച്ച് സമയത്തിന് ശേഷം അമോണിയയുടെ ഒരു ഭാഗം നൈട്രജനും ഹൈഡ്രജനുമായി വിഘടിച്ചതായി മാറുന്നു, അതായത്. പ്രതികരണം വിപരീത ദിശയിൽ തുടരുന്നു.
രാസ സന്തുലിതാവസ്ഥയുടെ സ്വഭാവം മനസിലാക്കാൻ, മുന്നോട്ട്, വിപരീത പ്രതികരണങ്ങളുടെ നിരക്ക് പരിഗണിക്കേണ്ടത് ആവശ്യമാണ്. ഒരു യൂണിറ്റ് സമയത്തിന് ആരംഭിക്കുന്ന പദാർത്ഥത്തിൻ്റെ അല്ലെങ്കിൽ പ്രതിപ്രവർത്തന ഉൽപ്പന്നത്തിൻ്റെ സാന്ദ്രതയിലെ മാറ്റമാണ് ഒരു രാസപ്രവർത്തനത്തിൻ്റെ നിരക്ക്. രാസ സന്തുലിതാവസ്ഥയുടെ പ്രശ്നങ്ങൾ പഠിക്കുമ്പോൾ, പദാർത്ഥങ്ങളുടെ സാന്ദ്രത mol / l ൽ പ്രകടിപ്പിക്കുന്നു; 1 ലിറ്റർ കണ്ടെയ്നറിൽ നൽകിയിരിക്കുന്ന പ്രതിപ്രവർത്തനത്തിൻ്റെ എത്ര മോളുകൾ അടങ്ങിയിട്ടുണ്ടെന്ന് ഈ സാന്ദ്രത കാണിക്കുന്നു. ഉദാഹരണത്തിന്, "അമോണിയ സാന്ദ്രത 3 mol/l ആണ്" എന്ന പ്രസ്താവന അർത്ഥമാക്കുന്നത്, വോളിയത്തിൻ്റെ ഓരോ ലിറ്ററിലും 3 മോളുകൾ അമോണിയ അടങ്ങിയിരിക്കുന്നു എന്നാണ്.
രാസപ്രവർത്തനങ്ങൾതന്മാത്രകൾ തമ്മിലുള്ള കൂട്ടിയിടിയുടെ ഫലമായാണ് ഇത് നടപ്പിലാക്കുന്നത്, അതിനാൽ, ഒരു യൂണിറ്റ് വോള്യത്തിൽ കൂടുതൽ തന്മാത്രകൾ ഉണ്ട്, അവയ്ക്കിടയിൽ കൂടുതൽ തവണ കൂട്ടിയിടികൾ സംഭവിക്കുന്നു, പ്രതികരണ നിരക്ക് വർദ്ധിക്കുന്നു. അങ്ങനെ, പ്രതിപ്രവർത്തനങ്ങളുടെ സാന്ദ്രത കൂടുന്തോറും പ്രതികരണ നിരക്ക് വർദ്ധിക്കും.
സിസ്റ്റത്തിൽ ഒരു സന്തുലിതാവസ്ഥയും നിരീക്ഷിക്കപ്പെടുന്നില്ല
ദൃശ്യമായ മാറ്റങ്ങളൊന്നുമില്ല.
ഉദാഹരണത്തിന്, സിസ്റ്റത്തിൽ ബാഹ്യ സ്വാധീനം ഇല്ലെങ്കിൽ, എല്ലാ വസ്തുക്കളുടെയും സാന്ദ്രത അനിശ്ചിതമായി വളരെക്കാലം മാറ്റമില്ലാതെ തുടരും. രാസ സന്തുലിതാവസ്ഥയിലുള്ള ഒരു സിസ്റ്റത്തിലെ സാന്ദ്രതയുടെ ഈ സ്ഥിരത പ്രതിപ്രവർത്തനത്തിൻ്റെ അഭാവത്തെ അർത്ഥമാക്കുന്നില്ല, കൂടാതെ മുന്നോട്ട്, വിപരീത പ്രതികരണങ്ങൾ ഒരേ നിരക്കിൽ നടക്കുന്നു എന്ന വസ്തുത വിശദീകരിക്കുന്നു. ഈ അവസ്ഥയെ യഥാർത്ഥ രാസ സന്തുലിതാവസ്ഥ എന്നും വിളിക്കുന്നു. അങ്ങനെ, യഥാർത്ഥ രാസ സന്തുലിതാവസ്ഥ ഒരു ചലനാത്മക സന്തുലിതാവസ്ഥയാണ്.
തെറ്റായ സന്തുലിതാവസ്ഥയെ യഥാർത്ഥ സന്തുലിതാവസ്ഥയിൽ നിന്ന് വേർതിരിച്ചറിയണം. സിസ്റ്റം പാരാമീറ്ററുകളുടെ സ്ഥിരത (പദാർത്ഥങ്ങളുടെ സാന്ദ്രത, മർദ്ദം, താപനില) യഥാർത്ഥ രാസ സന്തുലിതാവസ്ഥയുടെ ആവശ്യമുള്ളതും എന്നാൽ അപര്യാപ്തവുമായ അടയാളമാണ്. ഇനിപ്പറയുന്ന ഉദാഹരണത്തിലൂടെ ഇത് വ്യക്തമാക്കാം. അമോണിയയുടെ രൂപീകരണവുമായി നൈട്രജൻ്റെയും ഹൈഡ്രജൻ്റെയും പ്രതിപ്രവർത്തനവും അമോണിയയുടെ വിഘടനവും ഉയർന്ന താപനിലയിൽ (ഏകദേശം 500 ° C) ശ്രദ്ധേയമായ വേഗതയിൽ സംഭവിക്കുന്നു. ഊഷ്മാവിൽ ഏതെങ്കിലും അനുപാതത്തിൽ ഹൈഡ്രജൻ, നൈട്രജൻ, അമോണിയ എന്നിവ കലർത്തുകയാണെങ്കിൽ, പ്രതികരണം N 2 + 3 H 2 ⇆ 2 NH 3
ചോർച്ചയില്ല, കൂടാതെ എല്ലാ സിസ്റ്റം പാരാമീറ്ററുകളും സ്ഥിരമായ മൂല്യം നിലനിർത്തും. എന്നിരുന്നാലും, ഇൻ ഈ സാഹചര്യത്തിൽസന്തുലിതാവസ്ഥ തെറ്റാണ്, സത്യമല്ല, കാരണം അത് ചലനാത്മകമല്ല; സിസ്റ്റത്തിൽ കെമിക്കൽ ഇൻ്ററാക്ഷൻ ഇല്ല: ഫോർവേഡ്, റിവേഴ്സ് പ്രതിപ്രവർത്തനങ്ങളുടെ നിരക്ക് പൂജ്യമാണ്.
മെറ്റീരിയലിൻ്റെ കൂടുതൽ അവതരണത്തിൽ, യഥാർത്ഥ രാസ സന്തുലിതാവസ്ഥയുമായി ബന്ധപ്പെട്ട് "രാസ സന്തുലിതാവസ്ഥ" എന്ന പദം ഉപയോഗിക്കും.
രാസ സന്തുലിതാവസ്ഥയിലുള്ള ഒരു സിസ്റ്റത്തിൻ്റെ അളവ് സ്വഭാവമാണ് സന്തുലിത സ്ഥിരാങ്കം കെ .
റിവേഴ്സിബിൾ പ്രതികരണത്തിൻ്റെ പൊതുവായ സാഹചര്യത്തിൽ a A + b B + ... ⇆ p P + q Q + ...
സന്തുലിത സ്ഥിരാങ്കം ഇനിപ്പറയുന്ന ഫോർമുല ഉപയോഗിച്ച് പ്രകടിപ്പിക്കുന്നു:
ഫോർമുല 5.1 C(A), C(B), C(P) C(Q) പ്രതിപ്രവർത്തനത്തിൽ പങ്കെടുക്കുന്ന എല്ലാ വസ്തുക്കളുടെയും സന്തുലിത സാന്ദ്രത (mol/l) ആണ്, അതായത്. രാസ സന്തുലിതാവസ്ഥയുടെ നിമിഷത്തിൽ സിസ്റ്റത്തിൽ സ്ഥാപിക്കുന്ന സാന്ദ്രത; എ, ബി, പി, ക്യു - പ്രതികരണ സമവാക്യത്തിലെ സ്റ്റോയിയോമെട്രിക് ഗുണകങ്ങൾ.
അമോണിയ സിന്തസിസ് പ്രതിപ്രവർത്തനം N 2 +3H 2 ⇆2NH 3 എന്നതിനായുള്ള സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ പദപ്രയോഗത്തിന് ഇനിപ്പറയുന്ന രൂപമുണ്ട്: . (5.2)
അതിനാൽ, രാസ സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ സംഖ്യാ മൂല്യം പ്രതിപ്രവർത്തന ഉൽപ്പന്നങ്ങളുടെ സന്തുലിത സാന്ദ്രതയുടെ ഉൽപ്പന്നത്തിൻ്റെ അനുപാതത്തിന് തുല്യമാണ്, കൂടാതെ ആരംഭ പദാർത്ഥങ്ങളുടെ സന്തുലിത സാന്ദ്രതയുടെ ഉൽപന്നവും, ഓരോ പദാർത്ഥത്തിൻ്റെയും സാന്ദ്രത ഒരു ശക്തിയിലേക്ക് ഉയർത്തണം. പ്രതിപ്രവർത്തന സമവാക്യത്തിലെ സ്റ്റോയ്ചിയോമെട്രിക് ഗുണകത്തിന് തുല്യമാണ്.
അത് മനസ്സിലാക്കേണ്ടത് പ്രധാനമാണ് സന്തുലിത സ്ഥിരാങ്കം സന്തുലിത സാന്ദ്രതയുടെ അടിസ്ഥാനത്തിൽ പ്രകടിപ്പിക്കുന്നു, പക്ഷേ അവയെ ആശ്രയിക്കുന്നില്ല ; നേരെമറിച്ച്, പ്രതികരണത്തിൽ പങ്കെടുക്കുന്ന പദാർത്ഥങ്ങളുടെ സന്തുലിത സാന്ദ്രതയുടെ അനുപാതം സന്തുലിത സ്ഥിരാങ്കവുമായി പൊരുത്തപ്പെടുന്ന തരത്തിലായിരിക്കും. സന്തുലിത സ്ഥിരാങ്കം പ്രതിപ്രവർത്തനങ്ങളുടെയും താപനിലയുടെയും സ്വഭാവത്തെ ആശ്രയിച്ചിരിക്കുന്നു, ഇത് ഒരു സ്ഥിരാങ്കമാണ് (at സ്ഥിരമായ താപനില) മൂല്യം .
കെ >> 1 ആണെങ്കിൽ, സന്തുലിത സ്ഥിരമായ പദപ്രയോഗത്തിൻ്റെ ഭിന്നസംഖ്യയുടെ ന്യൂമറേറ്റർ ഡിനോമിനേറ്ററിനേക്കാൾ പലമടങ്ങ് വലുതാണ്, അതിനാൽ, സന്തുലിതാവസ്ഥയുടെ സമയത്ത്, പ്രതികരണ ഉൽപ്പന്നങ്ങൾ സിസ്റ്റത്തിൽ പ്രബലമാണ്, അതായത്. പ്രതികരണം പ്രധാനമായും മുന്നോട്ട് നീങ്ങുന്നു.
എങ്കിൽ കെ<< 1, то знаменатель во много раз превышает числитель, следовательно, в момент равновесия в системе преобладают исходные вещества, т.е. реакция лишь в незначительной степени протекает в прямом направлении.
K ≈ 1 ആണെങ്കിൽ, ആരംഭ പദാർത്ഥങ്ങളുടെയും പ്രതികരണ ഉൽപ്പന്നങ്ങളുടെയും സന്തുലിത സാന്ദ്രത താരതമ്യപ്പെടുത്താവുന്നതാണ്; പ്രതികരണം മുന്നോട്ട്, വിപരീത ദിശകളിൽ ശ്രദ്ധേയമായ അളവിൽ തുടരുന്നു.
സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ പദപ്രയോഗത്തിൽ വാതക ഘട്ടത്തിലോ അലിഞ്ഞുപോയ അവസ്ഥയിലോ ഉള്ള (പ്രതികരണം ലായനിയിൽ സംഭവിക്കുകയാണെങ്കിൽ) മാത്രം ഉള്ള പദാർത്ഥങ്ങളുടെ സാന്ദ്രത ഉൾപ്പെടുന്നു എന്നത് ഓർമ്മിക്കേണ്ടതാണ്. ഒരു ഖര പദാർത്ഥം പ്രതിപ്രവർത്തനത്തിൽ ഉൾപ്പെട്ടിട്ടുണ്ടെങ്കിൽ, പ്രതിപ്രവർത്തനം അതിൻ്റെ ഉപരിതലത്തിൽ സംഭവിക്കുന്നു, അതിനാൽ ഖര പദാർത്ഥത്തിൻ്റെ സാന്ദ്രത സ്ഥിരമാണെന്ന് അനുമാനിക്കപ്പെടുകയും സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ പ്രകടനത്തിൽ എഴുതുകയും ചെയ്യുന്നില്ല.
CO 2 (ഗ്യാസ്) + C (ഖര) ⇆ 2 CO (ഗ്യാസ്)
CaCO 3 (ഖര) ⇆ CaO (ഖര) + CO 2 (ഗ്യാസ്) K = C(CO 2)
Ca 3 (PO 4) 2 (ഖര) ⇆ 3Ca 2+ (പരിഹാരം) + 2PO 4 3– (പരിഹാരം) K = C 3 (Ca 2+) C 2 (PO 4 3–)
രാസ സന്തുലിതാവസ്ഥ എന്നത് വിപരീത രാസപ്രവർത്തനത്തിൻ്റെ അവസ്ഥയാണ്.
aA+ ബി B= സി C+ ഡിഡി,
അതിൽ കാലക്രമേണ പ്രതിപ്രവർത്തന മിശ്രിതത്തിലെ പ്രതിപ്രവർത്തനങ്ങളുടെ സാന്ദ്രതയിൽ മാറ്റമില്ല. രാസ സന്തുലിതാവസ്ഥയുടെ അവസ്ഥ സ്വഭാവ സവിശേഷതയാണ് രാസ സന്തുലിത സ്ഥിരാങ്കം:
എവിടെ സി ഐ- ഘടകങ്ങളുടെ സാന്ദ്രത സന്തുലിതാവസ്ഥതികഞ്ഞ മിശ്രിതം.
സന്തുലിത മോളുകളുടെ ഭിന്നസംഖ്യകളുടെ അടിസ്ഥാനത്തിലും സന്തുലിത സ്ഥിരാങ്കം പ്രകടിപ്പിക്കാം X iഘടകങ്ങൾ:
വാതക ഘട്ടത്തിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനങ്ങൾക്ക്, സന്തുലിത ഭാഗിക മർദ്ദത്തിൻ്റെ അടിസ്ഥാനത്തിൽ സന്തുലിത സ്ഥിരാങ്കം പ്രകടിപ്പിക്കുന്നത് സൗകര്യപ്രദമാണ്. പി ഐഘടകങ്ങൾ:
അനുയോജ്യമായ വാതകങ്ങൾക്ക് പി ഐ = സി ഐ ആർടിഒപ്പം പി ഐ = എക്സ് ഐ പി, എവിടെ പിമൊത്തം സമ്മർദ്ദമാണ്, അതിനാൽ കെ.പി, കെ സിഒപ്പം കെ എക്സ്ഇനിപ്പറയുന്ന ബന്ധങ്ങളാൽ ബന്ധപ്പെട്ടിരിക്കുന്നു:
കെ പി = കെ സി (ആർടി) സി+ഡി–എ–ബി = കെ എക്സ് പി സി+ഡി–എ–ബി. (9.4)
സന്തുലിത സ്ഥിരാങ്കം ബന്ധപ്പെട്ടിരിക്കുന്നു ആർ ജി o രാസപ്രവർത്തനം:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
മാറ്റുക ആർ ജിഅഥവാ ആർ എഫ്നൽകിയിട്ടുള്ള (സന്തുലിതാവസ്ഥ ആവശ്യമില്ല) ഭാഗിക മർദ്ദത്തിൽ ഒരു രാസപ്രവർത്തനത്തിൽ പി ഐഅല്ലെങ്കിൽ ഏകാഗ്രതകൾ സി ഐസമവാക്യം ഉപയോഗിച്ച് ഘടകങ്ങൾ കണക്കാക്കാം രാസപ്രവർത്തനം ഐസോതെർമുകൾ (വാൻ ഹോഫ് ഐസോതെർമുകൾ അല്ല):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
ഇതനുസരിച്ച് ലെ ചാറ്റിലിയറുടെ തത്വം, സന്തുലിതാവസ്ഥയിലുള്ള ഒരു സിസ്റ്റത്തിൽ ബാഹ്യ സ്വാധീനം ചെലുത്തുകയാണെങ്കിൽ, ബാഹ്യ സ്വാധീനത്തിൻ്റെ പ്രഭാവം കുറയ്ക്കുന്നതിന് സന്തുലിതാവസ്ഥ മാറുന്നു. അങ്ങനെ, സമ്മർദ്ദം വർദ്ധിക്കുന്നത് വാതക തന്മാത്രകളുടെ എണ്ണത്തിൽ കുറവിലേക്ക് സന്തുലിതാവസ്ഥയെ മാറ്റുന്നു. ഒരു സന്തുലിത മിശ്രിതത്തിലേക്ക് ഏതെങ്കിലും പ്രതികരണ ഘടകം ചേർക്കുന്നത് ഈ ഘടകത്തിൻ്റെ അളവ് കുറയുന്നതിലേക്ക് സന്തുലിതാവസ്ഥയെ മാറ്റുന്നു. താപനിലയിലെ വർദ്ധനവ് (അല്ലെങ്കിൽ കുറയുന്നു) താപത്തിൻ്റെ ആഗിരണം (റിലീസ്) കൊണ്ട് സംഭവിക്കുന്ന ഒരു പ്രതികരണത്തിലേക്ക് സന്തുലിതാവസ്ഥയെ മാറ്റുന്നു.
താപനിലയിലെ സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ അളവ് ആശ്രിതത്വം സമവാക്യം വിവരിക്കുന്നു രാസപ്രവർത്തനം ഐസോബാറുകൾ (വാൻ ഹോഫ് ഐസോബാറുകൾ അല്ല)
![]() (9.9)
(9.9)
ഒപ്പം ഒരു രാസപ്രവർത്തനത്തിൻ്റെ ഐസോകോറുകൾ (van't Hoff isochores)
![]() . (9.10)
. (9.10)
എന്ന അനുമാനത്തിൽ സമവാക്യം (9.9) സംയോജിപ്പിക്കുന്നു ആർ എച്ച്പ്രതികരണം താപനിലയെ ആശ്രയിക്കുന്നില്ല (ഇത് ഇടുങ്ങിയ താപനില പരിധികളിൽ ശരിയാണ്), നൽകുന്നു:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
എവിടെ സി -സംയോജന സ്ഥിരാങ്കം. അങ്ങനെ, ആശ്രിതത്വം ln കെ 1 മുതൽ പി /ടിരേഖീയമായിരിക്കണം, നേർരേഖയുടെ ചരിവ് - ആർ എച്ച്/ആർ.
ഉള്ളിൽ സംയോജനം കെ 1 , കെ 2, ഒപ്പം ടി 1, ടി 2 നൽകുന്നു:
 (9.13)
(9.13)
 (9.14)
(9.14)
ഈ സമവാക്യം ഉപയോഗിച്ച്, രണ്ട് വ്യത്യസ്ത താപനിലകളിലെ സന്തുലിത സ്ഥിരാങ്കങ്ങൾ അറിയുന്നതിലൂടെ, നമുക്ക് കണക്കാക്കാം ആർ എച്ച്പ്രതികരണങ്ങൾ. അതനുസരിച്ച്, അറിയുന്നു ആർ എച്ച്പ്രതികരണവും ഒരു താപനിലയിലെ സന്തുലിത സ്ഥിരാങ്കവും, നിങ്ങൾക്ക് മറ്റൊരു താപനിലയിൽ സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കാം.
ഉദാഹരണങ്ങൾ
CO(g) + 2H 2 (g) = CH 3 OH(g)
500 കെ.യിൽ. എഫ് ജി ഒ CO(g), CH 3 OH(g) എന്നിവ 500 K -155.41 kJ ന് തുല്യമാണ്. mol -1, -134.20 kJ. mol -1 യഥാക്രമം.
പരിഹാരം. ജി ഒപ്രതികരണങ്ങൾ:
ആർ ജി ഒ= എഫ് ജി ഒ(CH 3 OH) - എഫ് ജി ഒ(CO) = –134.20 – (–155.41) = 21.21 kJ. mol -1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
ഉദാഹരണം 9-2. പ്രതികരണ സന്തുലിത സ്ഥിരാങ്കം
തുല്യമാണ് കെ 400 o C യിൽ P = 1.64 10 –4. N 2-ൻ്റെ 10% NH 3 ആയി മാറുന്ന തരത്തിൽ N 2, H 2 എന്നിവയുടെ ഇക്വിമോളാർ മിശ്രിതത്തിൽ മൊത്തം എത്ര മർദ്ദം പ്രയോഗിക്കണം? വാതകങ്ങൾ അനുയോജ്യമായി കണക്കാക്കപ്പെടുന്നു.
പരിഹാരം. N 2 ൻ്റെ ഒരു മോൾ പ്രതികരിക്കട്ടെ. പിന്നെ
| N 2 (g) | + | 3H 2 (ഗ്രാം) | = | 2NH 3 (ഗ്രാം) | |
| യഥാർത്ഥ അളവ് | 1 | 1 | |||
| സന്തുലിത അളവ് | 1– | 1–3 | 2 (ആകെ: 2–2) | ||
| സന്തുലിത മോളിലെ അംശം: |
അതിനാൽ, കെ X = 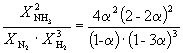 ഒപ്പം കെ പി = കെ എക്സ്. പി –2
=
ഒപ്പം കെ പി = കെ എക്സ്. പി –2
=  .
.
തത്ഫലമായുണ്ടാകുന്ന ഫോർമുലയിലേക്ക് = 0.1 മാറ്റിസ്ഥാപിക്കുന്നു, നമുക്കുണ്ട്
1.64 10 –4 = , എവിടെ പി= 51.2 എടിഎം.
, എവിടെ പി= 51.2 എടിഎം.
ഉദാഹരണം 9-3. പ്രതികരണ സന്തുലിത സ്ഥിരാങ്കം
CO(g) + 2H 2 (g) = CH 3 OH(g)
500 K ന് തുല്യമാണ് കെപി = 6.09 10 –3 . 1 mol CO, 2 mol H 2, 1 mol നിഷ്ക്രിയ വാതകം (N 2) എന്നിവ അടങ്ങിയ ഒരു പ്രതിപ്രവർത്തന മിശ്രിതം 500 K ലേക്ക് ചൂടാക്കുകയും മൊത്തം മർദ്ദം 100 atm ആണ്. സന്തുലിത മിശ്രിതത്തിൻ്റെ ഘടന കണക്കാക്കുക.
പരിഹാരം. CO യുടെ ഒരു മോൾ പ്രതികരിക്കട്ടെ. പിന്നെ
| CO(g) | + | 2H 2 (g) | = | CH3OH(g) | |
| യഥാർത്ഥ അളവ്: | 1 | 2 | 0 | ||
| സന്തുലിത അളവ്: | 1– | 2–2 | |||
| സന്തുലിത മിശ്രിതത്തിൽ ആകെ: | 3-2 മോൾ ഘടകങ്ങൾ + 1 മോൾ എൻ 2 = 4-2 മോൾ | ||||
| സന്തുലിത മോളിലെ അംശം | |||||
അതിനാൽ, കെ X =  ഒപ്പം കെ പി = കെ എക്സ്. പി–2 =
ഒപ്പം കെ പി = കെ എക്സ്. പി–2 = ![]() .
.
അങ്ങനെ, 6.09 10 –3 = ![]() .
.
ഈ സമവാക്യം പരിഹരിക്കുമ്പോൾ, നമുക്ക് = 0.732 ലഭിക്കും. അതനുസരിച്ച്, സന്തുലിത മിശ്രിതത്തിലെ പദാർത്ഥങ്ങളുടെ മോൾ ഭിന്നസംഖ്യകൾ തുല്യമാണ്: = 0.288, = 0.106, = 0.212 ഒപ്പം = 0.394.
ഉദാഹരണം 9-4. പ്രതികരണത്തിനായി
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
298 കെ.യിൽ കെപി = 6.0 10 5, എ എഫ് എച്ച് ഒ(NH 3) = –46.1 kJ. mol -1. സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ മൂല്യം 500 കെയിൽ കണക്കാക്കുക.
പരിഹാരം. പ്രതിപ്രവർത്തനത്തിൻ്റെ സ്റ്റാൻഡേർഡ് മോളാർ എൻതാൽപ്പി
ആർ എച്ച് ഒ= 2എഫ് എച്ച് ഒ(NH 3) = –92.2 kJ. mol -1.
സമവാക്യം അനുസരിച്ച് (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, എവിടെ നിന്ന് കെ 2 =
0.18.
= –1.73, എവിടെ നിന്ന് കെ 2 =
0.18.
ഒരു എക്സോതെർമിക് പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കം താപനില വർദ്ധിക്കുന്നതിനനുസരിച്ച് കുറയുന്നു, ഇത് ലെ ചാറ്റിലിയറിൻ്റെ തത്വവുമായി യോജിക്കുന്നു.
ചുമതലകൾ
- 1273 കെയിൽ, ഒരു സന്തുലിത മിശ്രിതത്തിൽ ആകെ മർദ്ദം 30 എടിഎം
- 2000 o C ലും 1 atm ൻ്റെ മൊത്തം മർദ്ദത്തിലും 2% ജലം ഹൈഡ്രജനും ഓക്സിജനുമായി വിഘടിപ്പിക്കപ്പെടുന്നു. പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കുക
- പ്രതികരണ സന്തുലിത സ്ഥിരാങ്കം
- പ്രതികരണ സന്തുലിത സ്ഥിരാങ്കം
- 1.79 10 -2 mol I 2 അടങ്ങിയ 3 ലിറ്റർ പാത്രം 973 K വരെ ചൂടാക്കി. സന്തുലിതാവസ്ഥയിലുള്ള പാത്രത്തിലെ മർദ്ദം 0.49 atm ആയി മാറി. വാതകങ്ങൾ അനുയോജ്യമാണെന്ന് കരുതുക, പ്രതിപ്രവർത്തനത്തിന് 973 കെയിൽ സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കുക
- പ്രതികരണത്തിനായി
- പ്രതികരണത്തിനായി
- 0.341 mol PCl 5 ഉം 0.233 mol N 2 ഉം അടങ്ങിയ 1-ലിറ്റർ പാത്രം 250 o C വരെ ചൂടാക്കി. സന്തുലിതാവസ്ഥയിലുള്ള പാത്രത്തിലെ മൊത്തം മർദ്ദം 29.33 atm ആയി മാറി. എല്ലാ വാതകങ്ങളും അനുയോജ്യമാണെന്ന് കരുതുക, പാത്രത്തിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനത്തിന് 250 o C എന്ന സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കുക.
- പ്രതികരണ സന്തുലിത സ്ഥിരാങ്കം
- 25 o C ന് എഫ് ജി ഒ(NH 3) = –16.5 kJ. mol -1. കണക്കാക്കുക ആർ ജി N 2, H 2, NH 3 എന്നിവയുടെ ഭാഗിക മർദ്ദത്തിൽ യഥാക്രമം 3 atm, 1 atm, 4 atm എന്നിവയ്ക്ക് തുല്യമായ NH 3 രൂപീകരണത്തിൻ്റെ പ്രതികരണങ്ങൾ. ഈ സാഹചര്യങ്ങളിൽ പ്രതികരണം ഏത് ദിശയിലേക്കാണ് സ്വയമേവ മുന്നോട്ട് പോകുന്നത്?
- എക്സോതെർമിക് പ്രതികരണം
- ഐസോബോർണിയോൾ (C 10 H 17 OH) ഐസോമറൈസേഷൻ ഗ്യാസ്-ഫേസ് പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കം 0.106 ആണ്. സന്തുലിതാവസ്ഥ കൈവരിക്കുന്നതുവരെ 503 കെ. സന്തുലിത മിശ്രിതത്തിലെ ബോർണിയോളിൻ്റെയും ഐസോബോർണിയോളിൻ്റെയും മോൾ ഭിന്നസംഖ്യകളും പിണ്ഡങ്ങളും കണക്കാക്കുക.
- പ്രതികരണത്തിലെ സന്തുലിതാവസ്ഥ
- 400 o C വോളിയത്തിൽ 10% NH 3 അടങ്ങിയ ഒരു സന്തുലിത മിശ്രിതം ലഭിക്കുന്നതിന് 3 ഭാഗങ്ങൾ H 2, 1 ഭാഗം N 2 എന്നിവയുടെ മിശ്രിതത്തിൽ പ്രയോഗിക്കേണ്ട മൊത്തം മർദ്ദം കണക്കാക്കുക. പ്രതിപ്രവർത്തനത്തിനുള്ള സന്തുലിത സ്ഥിരാങ്കം
- 250 o C ലും 1 atm ൻ്റെ മൊത്തം മർദ്ദത്തിലും, PCl 5 പ്രതിപ്രവർത്തനം വഴി 80% വിഘടിപ്പിക്കപ്പെടുന്നു.
- പ്രതികരണത്തിന് 2000 o C
- സന്തുലിത സ്ഥിരാങ്കമായ പ്രതിപ്രവർത്തനത്തിൻ്റെ സ്റ്റാൻഡേർഡ് എൻതാൽപ്പി കണക്കാക്കുക
a) 2 മടങ്ങ് വർദ്ധിക്കുന്നു, b) താപനില 298 K ൽ നിന്ന് 308 K ആയി മാറുമ്പോൾ 2 മടങ്ങ് കുറയുന്നു. - 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) എന്ന പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ ആശ്രിതത്വം 300 K നും 600 K നും ഇടയിലുള്ള താപനിലയെ സമവാക്യം വിവരിക്കുന്നു.
CO 2 (g) + C(tv) = 2CO(g)
17% (വോളിയം അനുസരിച്ച്) CO 2 അടങ്ങിയിരിക്കുന്നു. മൊത്തം 20 atm മർദ്ദത്തിൽ CO 2 ൻ്റെ എത്ര ശതമാനം വാതകത്തിൽ അടങ്ങിയിരിക്കും? ഏത് സമ്മർദ്ദത്തിലാണ് വാതകത്തിൽ 25% CO 2 അടങ്ങിയിരിക്കുന്നത്?
ഈ വ്യവസ്ഥകളിൽ H 2 O (g) = H 2 (g) + 1/2O 2 (g).
CO(g) + H 2 O(g) = CO 2 (g) + H 2 (g)
500 o C ന് തുല്യമാണ് കെ പി= 5.5. 1 mol CO ഉം 5 mol H 2 O ഉം അടങ്ങിയ ഒരു മിശ്രിതം ഈ താപനിലയിൽ ചൂടാക്കി. സന്തുലിത മിശ്രിതത്തിൽ H 2 O യുടെ മോൾ അംശം കണക്കാക്കുക.
N 2 O 4 (g) = 2NO 2 (g)
25 o C ന് തുല്യമാണ് കെ പി= 0.143. 1 ലിറ്റർ വോളിയമുള്ള ഒരു പാത്രത്തിൽ സ്ഥാപിക്കുന്ന മർദ്ദം കണക്കാക്കുക, അതിൽ 1 ഗ്രാം N 2 O 4 ഈ താപനിലയിൽ സ്ഥാപിച്ചിരിക്കുന്നു.
I 2 (g) = 2I (g).
250 o C യിൽ ആർ ജി o = –2508 J mol –1. 250 o C യിൽ PCl 5 ൻ്റെ PCl 3 ആയും Cl 2 ലേക്ക് പരിവർത്തനം ചെയ്യുന്നതിൻ്റെ അളവ് 30% ആയിരിക്കും?
2HI(g) = H 2 (g) + I 2 (g)
സന്തുലിത സ്ഥിരാങ്കം കെ P = 1.83 10 –2 698.6 K. മൂന്ന് ലിറ്റർ പാത്രത്തിൽ 10 ഗ്രാം I 2 ഉം 0.2 g H 2 ഉം ഈ താപനിലയിൽ ചൂടാക്കുമ്പോൾ എത്ര ഗ്രാം HI രൂപപ്പെടുന്നു? H 2, I 2, HI എന്നിവയുടെ ഭാഗിക സമ്മർദ്ദങ്ങൾ എന്തൊക്കെയാണ്?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH(g)
500 K ന് തുല്യമാണ് കെപി = 6.09 10 –3 . CO, H2 എന്നിവ 1:2 അനുപാതത്തിൽ എടുക്കുകയാണെങ്കിൽ 90% വിളവിൽ മെഥനോൾ ഉൽപ്പാദിപ്പിക്കുന്നതിന് ആവശ്യമായ മൊത്തം മർദ്ദം കണക്കാക്കുക.
CO(g) + 2H 2 (g) = CH 3 OH(g)
500 കെയിലും 10 ബാറിലും സന്തുലിതാവസ്ഥയിലാണ്. വാതകങ്ങൾ അനുയോജ്യമാണെങ്കിൽ, ഇനിപ്പറയുന്ന ഘടകങ്ങൾ മെഥനോളിൻ്റെ വിളവിനെ എങ്ങനെ ബാധിക്കും: a) വർദ്ധനവ് ടി; ബി) പ്രമോഷൻ പി; സി) നിഷ്ക്രിയ വാതകം ചേർക്കുന്നു വി= കോൺസ്റ്റ്; d) നിഷ്ക്രിയ വാതകം ചേർക്കുന്നു പി= കോൺസ്റ്റ്; e) H 2 ചേർക്കുന്നു പി= കോൺസ്റ്റ്?
2NOCl(g) = 2NO(g) + Cl 2 (g)
227 o C ആയി സജ്ജീകരിക്കുകയും NOCl ൻ്റെ ഭാഗിക മർദ്ദം 0.64 ബാർ ആകുമ്പോൾ മൊത്തം മർദ്ദം 1.0 ബാർ ആകുകയും ചെയ്യുന്നു (തുടക്കത്തിൽ NOCl മാത്രമേ ഉണ്ടായിരുന്നുള്ളൂ). കണക്കാക്കുക ആർ ജി ഒപ്രതികരണത്തിനായി. ഏത് മൊത്തം മർദ്ദത്തിലാണ് Cl 2 ൻ്റെ ഭാഗിക മർദ്ദം 0.10 ബാറിന് തുല്യമായിരിക്കും?
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
400 o C ന് തുല്യമാണ് കെ = 1.60 10 –4 .
PCl 5 (g) = PCl 3 (g) + Cl 2 (g).
നൈട്രജൻ്റെ ഭാഗിക മർദ്ദം 0.9 atm ആകുന്നതിനായി N 2 സിസ്റ്റത്തിലേക്ക് ചേർത്താൽ PCl 5 ൻ്റെ വിഘടനത്തിൻ്റെ അളവ് എത്രയായിരിക്കും? മൊത്തം മർദ്ദം 1 atm ൽ നിലനിർത്തുന്നു.
N 2 (g) + O 2 (g) = 2NO (g)
കെ പി = 2.5 10 -3. 1 ബാറിൻ്റെ മൊത്തം മർദ്ദത്തിൽ N 2, O 2, NO, നിഷ്ക്രിയ വാതകം എന്നിവയുടെ സന്തുലിത മിശ്രിതത്തിൽ 80% (വോളിയം അനുസരിച്ച്) N 2, 16% O 2 എന്നിവ അടങ്ങിയിരിക്കുന്നു. വോളിയം അനുസരിച്ച് എത്ര ശതമാനം NO ആണ്? ഒരു നിഷ്ക്രിയ വാതകത്തിൻ്റെ ഭാഗിക മർദ്ദം എന്താണ്?
ln കെ = –1.04 –1088 /ടി +1.51 10 5 /ടി 2 .
രസതന്ത്രത്തിലും പ്രകൃതി ശാസ്ത്രത്തിലും സ്വയം സമർപ്പിക്കാൻ തീരുമാനിച്ച 9-10 ഗ്രേഡുകളിലെ സെക്കൻഡറി സ്കൂൾ അധ്യാപകർ, പെഡഗോഗിക്കൽ യൂണിവേഴ്സിറ്റി വിദ്യാർത്ഥികൾ, സ്കൂൾ കുട്ടികൾ എന്നിവർക്കായി
പാഠപുസ്തകം · പ്രശ്നക്കാരൻ · ലബോറട്ടറി പ്രാക്ടീസ് · വായിക്കാൻ ശാസ്ത്രീയ കഥകൾ
§ 3.2. സന്തുലിത സ്ഥിരാങ്കം
ഐസോബാറിക് പ്രതിപ്രവർത്തന സാധ്യതയും
സമതുലിത സ്ഥിരാങ്കം ഐസോബാറിക് പൊട്ടൻഷ്യലിൻ്റെ മൂല്യത്തിൽ നിന്ന് എളുപ്പത്തിൽ കണ്ടെത്താനാകും, ഇത് ആരംഭ പദാർത്ഥങ്ങളുടെയും പ്രതികരണ ഉൽപ്പന്നങ്ങളുടെയും രൂപീകരണത്തിൻ്റെയും എൻട്രോപ്പിയുടെയും എൻതാൽപ്പിയെക്കുറിച്ചുള്ള പട്ടികപ്പെടുത്തിയ ഡാറ്റയിൽ നിന്ന് കണക്കാക്കുന്നു.
പഠിക്കുന്ന പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കേണ്ടിവരുമ്പോൾ നിങ്ങൾക്ക് ഈ ഫോർമുല ആവശ്യമാണ്.
ഈ പാഠപുസ്തകത്തിൽ, ഞങ്ങൾ റെഡിമെയ്ഡ് ഫോർമുലകൾ നൽകാനല്ല, മറിച്ച് ഗണിതശാസ്ത്ര യുക്തിയുടെ ഏറ്റവും ലളിതമായ രീതികൾ ഉപയോഗിച്ച് അവയെ ഉരുത്തിരിയാനാണ് ശ്രമിക്കുന്നത്, അതിനാൽ ഈ ഫോർമുലയുടെ ഡെറിവേഷൻ ചുവടെ നൽകിയിരിക്കുന്നു. ഈ മെറ്റീരിയൽ വായിച്ചതിനുശേഷം, പ്രോബബിലിറ്റി തിയറി, ആക്റ്റിവേഷൻ എൻട്രോപ്പി മുതലായവയുടെ ലളിതമായ ആശയങ്ങൾ നിങ്ങൾക്ക് പരിചിതമാകും.
ഒരു രാസപ്രവർത്തനത്തിൻ്റെ നിരക്ക് നിർണ്ണയിക്കുന്നത് സജീവമാക്കൽ ഊർജ്ജം മാത്രമല്ല. പ്രതികരിക്കുന്ന തന്മാത്രകളുടെ വലിപ്പവും രൂപവും റിയാക്ടീവ് ആറ്റങ്ങളുടെ സ്ഥാനവും അല്ലെങ്കിൽ അവയിലെ ഗ്രൂപ്പുകളും ഒരു വലിയ പങ്ക് വഹിക്കുന്നു. ഇക്കാര്യത്തിൽ, രണ്ട് കണികകൾ കൂട്ടിയിടിക്കുമ്പോൾ, അവയുടെ നിർദ്ദിഷ്ട ഓറിയൻ്റേഷൻ പ്രധാനമാണ്, അതായത്, കൃത്യമായി പ്രതികരിക്കുന്ന കേന്ദ്രങ്ങളുടെ സമ്പർക്കം.
W ൻ്റെ കൂട്ടിയിടി സമയത്ത് പ്രതിപ്രവർത്തനത്തിന് ആവശ്യമായ തന്മാത്രാ ഓറിയൻ്റേഷൻ്റെ സംഭാവ്യത നമുക്ക് സൂചിപ്പിക്കാം:
W മൂല്യത്തിൻ്റെ സ്വാഭാവിക ലോഗരിതം R എന്ന വാതക സ്ഥിരാങ്കം കൊണ്ട് ഗുണിച്ചാൽ ആക്റ്റിവേഷൻ എൻട്രോപ്പി S a:
![]()
ഈ പദപ്രയോഗത്തിൽ നിന്ന് ഇത് ഇപ്രകാരമാണ്:
![]()
ലോഗരിതത്തിൻ്റെ നിർവചനമനുസരിച്ച്, ആവശ്യമായ ഓറിയൻ്റേഷൻ്റെ സംഭാവ്യത നമുക്ക് എവിടെ നിന്ന് ലഭിക്കും:
പ്രതികരണം സംഭവിക്കുന്നതിന് ആവശ്യമായ ഓറിയൻ്റേഷൻ്റെ സംഭാവ്യത കൂടുന്നതിനനുസരിച്ച്, അതിൻ്റെ വേഗതയും അതനുസരിച്ച്, റേറ്റ് സ്ഥിരാങ്കവും, എഴുതാം:
മുമ്പ്, നിരക്ക് സ്ഥിരാങ്കം സജീവമാക്കൽ ഊർജ്ജത്തെയും താപനിലയെയും ആശ്രയിച്ചിരിക്കുന്നുവെന്ന് ഞങ്ങൾ മനസ്സിലാക്കി:
അതിനാൽ, നിരക്ക് സ്ഥിരാങ്കം സജീവമാക്കൽ ഊർജ്ജം, താപനില, സജീവമാക്കൽ എൻട്രോപ്പി എന്നിവയെ ആശ്രയിച്ചിരിക്കുന്നു:
![]()
നമുക്ക് ആനുപാതിക ഗുണകം Z അവതരിപ്പിക്കുകയും തുല്യ ചിഹ്നം ഇടുകയും ചെയ്യാം:
തത്ഫലമായുണ്ടാകുന്ന പദപ്രയോഗത്തെ വിളിക്കുന്നു രാസ ചലനാത്മകതയുടെ അടിസ്ഥാന സമവാക്യം.
ഈ സമവാക്യം കാറ്റലിസിസിൻ്റെ ചില വശങ്ങൾ വിശദീകരിക്കുന്നു: ഒരു ഉത്തേജക പ്രതിപ്രവർത്തനത്തിൻ്റെ സജീവമാക്കൽ ഊർജ്ജം കുറയ്ക്കുകയും ആക്റ്റിവേഷൻ്റെ എൻട്രോപ്പി വർദ്ധിപ്പിക്കുകയും ചെയ്യുന്നു, അതായത്, പ്രതിപ്രവർത്തനത്തിനായി പ്രതികരിക്കുന്ന കണങ്ങളുടെ ഉചിതമായ ഓറിയൻ്റേഷൻ്റെ സംഭാവ്യത ഇത് വർദ്ധിപ്പിക്കുന്നു.
ആക്ടിവേഷൻ എൻട്രോപ്പി കണങ്ങളുടെ നിർദ്ദിഷ്ട ഓറിയൻ്റേഷൻ മാത്രമല്ല, കൂട്ടിയിടിയുടെ നിമിഷത്തിലെ സമ്പർക്കത്തിൻ്റെ ദൈർഘ്യവും കണക്കിലെടുക്കുന്നു എന്നത് ശ്രദ്ധേയമാണ്. കണങ്ങൾ തമ്മിലുള്ള സമ്പർക്കത്തിൻ്റെ ദൈർഘ്യം വളരെ കുറവാണെങ്കിൽ, അവയുടെ ഇലക്ട്രോൺ സാന്ദ്രതയ്ക്ക് പുതിയ രാസ ബോണ്ടുകൾ രൂപീകരിക്കാൻ പുനർവിതരണം ചെയ്യാൻ സമയമില്ല, കൂടാതെ കണികകൾ, വികർഷണം, വ്യത്യസ്ത ദിശകളിലേക്ക് വ്യതിചലിക്കുന്നു. പ്രതിപ്രവർത്തന കണങ്ങളുടെ സമ്പർക്കത്തിൻ്റെ ദൈർഘ്യവും കാറ്റലിസ്റ്റ് ഗണ്യമായി വർദ്ധിപ്പിക്കുന്നു.
കാറ്റലറ്റിക് പ്രവർത്തനത്തിൻ്റെ മറ്റൊരു സവിശേഷത: പുതുതായി രൂപംകൊണ്ട കണത്തിൽ നിന്ന് ഉൽപ്രേരകം അധിക ഊർജ്ജം എടുക്കുന്നു, ഉയർന്ന ഊർജ്ജ പ്രവർത്തനം കാരണം അത് യഥാർത്ഥ കണങ്ങളിലേക്ക് വിഘടിക്കുന്നില്ല.
സമതുലിത സ്ഥിരാങ്കം മുന്നോട്ട്, വിപരീത പ്രതികരണങ്ങളുടെ നിരക്ക് സ്ഥിരാങ്കങ്ങളുടെ അനുപാതമാണെന്ന് നിങ്ങൾക്കറിയാം:
![]()
കെമിക്കൽ ഗതിവിജ്ഞാനത്തിൻ്റെ അടിസ്ഥാന സമവാക്യത്തിൻ്റെ എക്സ്പ്രഷനുകൾ ഉപയോഗിച്ച് ഫോർവേഡ്, റിവേഴ്സ് പ്രതികരണങ്ങളുടെ നിരക്ക് സ്ഥിരാങ്കങ്ങൾ മാറ്റിസ്ഥാപിക്കാം:

Z pr / Z arr എന്ന രണ്ട് ആനുപാതിക ഗുണകങ്ങളുടെ അനുപാതം ഒരു സ്ഥിരമായ മൂല്യമാണ്, അത് നമ്മൾ സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ മൂല്യത്തിലേക്ക് ചേർക്കും, അതിനാലാണ് ഇത് മുമ്പത്തെപ്പോലെ സ്ഥിരമായി തുടരുന്നത്.
എക്സ്പോണൻഷ്യൽ ഫംഗ്ഷനുകൾ ഉപയോഗിച്ച് പ്രവർത്തിക്കുന്നതിനുള്ള നിയമങ്ങൾ നിങ്ങൾ ഓർക്കുകയാണെങ്കിൽ, ഫോർമുലയുടെ പരിവർത്തനം നിങ്ങൾക്ക് മനസ്സിലാകും:
ഹെസ്സിൻ്റെ നിയമത്തിന് അനുസൃതമായി, റിവേഴ്സ്, ഫോർവേഡ് പ്രതികരണങ്ങളുടെ സജീവമാക്കൽ ഊർജ്ജങ്ങൾ തമ്മിലുള്ള വ്യത്യാസം എൻതാൽപ്പിയിലെ മാറ്റമാണ് (താപം പുറത്തുവിടുമ്പോൾ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനത്തിൻ്റെ ഒരു എൻതാൽപ്പി ഡയഗ്രം വരച്ച് ഇത് ഉറപ്പാക്കുക, അത് മറക്കരുത്. ഈ കാര്യം ഡി എൻ< 0 ):
![]()
കൃത്യമായി ഒരേ വ്യത്യാസം ![]() നമുക്ക് സൂചിപ്പിക്കാം ഡി എസ്:
നമുക്ക് സൂചിപ്പിക്കാം ഡി എസ്:
![]()
പരാൻതീസിസിനു മുന്നിൽ ഒരു മൈനസ് ചിഹ്നം ഉള്ളത് എന്തുകൊണ്ടെന്ന് വിശദീകരിക്കുക.
നമുക്ക് സമവാക്യം ലഭിക്കുന്നു:
ഈ സമവാക്യത്തിൻ്റെ ഇരുവശങ്ങളുടെയും ലോഗരിതം എടുക്കാം:
നമുക്ക് എവിടെ നിന്ന് ലഭിക്കും:
രസതന്ത്രത്തിനും മറ്റ് ശാസ്ത്രങ്ങൾക്കും ഈ സമവാക്യം വളരെ പ്രധാനമാണ്, പല വിദേശ രസതന്ത്ര വിദ്യാർത്ഥികളും ഈ ഫോർമുല ഉള്ള ഷർട്ടുകൾ ധരിക്കുന്നു.
എങ്കിൽ ഡി ജി J/mol-ൽ പ്രകടിപ്പിക്കുന്നു, തുടർന്ന് ഫോർമുല ഫോം എടുക്കുന്നു:
ഈ സൂത്രവാക്യത്തിന് ഒരു സവിശേഷതയുണ്ട്: സന്തുലിത സ്ഥിരാങ്കം വാതക പദാർത്ഥങ്ങളുടെ മർദ്ദത്തിലൂടെയാണ് നിർണ്ണയിക്കുന്നതെങ്കിൽ, അന്തരീക്ഷത്തിലെ ഈ പദാർത്ഥങ്ങളുടെ മർദ്ദം സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ (1 atm = 101325 Pa = 760 mm Hg) പദപ്രയോഗത്തിലേക്ക് മാറ്റിസ്ഥാപിക്കുന്നു.
അറിയപ്പെടുന്ന മൂല്യം നൽകിയാൽ ഈ ഫോർമുല അനുവദിക്കുന്നു, ഡി ജിപ്രതികരണം, സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കുക, അങ്ങനെ ഒരു നിശ്ചിത താപനിലയിൽ സന്തുലിത വ്യവസ്ഥയുടെ ഘടന കണ്ടെത്തുക. സമതുലിത പ്രതികരണ മിശ്രിതത്തിൽ അടങ്ങിയിരിക്കുന്ന ഉയർന്ന സന്തുലിത സ്ഥിരാങ്കവും കൂടുതൽ പ്രതികരണ ഉൽപ്പന്നങ്ങളും (പ്രതികരണ സമവാക്യത്തിൻ്റെ വലതുവശത്തുള്ള പദാർത്ഥങ്ങൾ) പ്രതിപ്രവർത്തനത്തിൻ്റെ ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം കൂടുതൽ പ്രതികൂലമാണെന്ന് ഫോർമുല കാണിക്കുന്നു. തിരിച്ചും, സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ മൂല്യം കുറയുകയും സന്തുലിത മിശ്രിതത്തിലെ പ്രതിപ്രവർത്തന ഉൽപ്പന്നങ്ങളും കൂടുതൽ ആരംഭ പദാർത്ഥങ്ങളും കുറയുകയും ചെയ്യുന്നു, ചെറിയ നെഗറ്റീവ് മൂല്യം ഡി ജി.
സന്തുലിത സ്ഥിരാങ്കം 1-ൽ കൂടുതലും ഐസോബാറിക് പൊട്ടൻഷ്യൽ നെഗറ്റീവ് ആണെങ്കിൽ, സന്തുലിതാവസ്ഥ പ്രതികരണ ഉൽപ്പന്നങ്ങളിലേക്കോ വലത്തോട്ടോ മാറുന്നുവെന്ന് പറയുന്നത് പതിവാണ്. സന്തുലിത സ്ഥിരാങ്കം 1-ൽ കുറവായിരിക്കുകയും ഐസോബാറിക് പൊട്ടൻഷ്യൽ പോസിറ്റീവ് ആയിരിക്കുകയും ചെയ്യുമ്പോൾ, സന്തുലിതാവസ്ഥ ആരംഭ പദാർത്ഥങ്ങളിലേക്കോ ഇടത്തോട്ടോ മാറുന്നുവെന്ന് പറയുന്നത് പതിവാണ്.
സന്തുലിത സ്ഥിരാങ്കം 1 ന് തുല്യമാകുമ്പോൾ, ഐസോബാറിക് പൊട്ടൻഷ്യൽ 0 ന് തുല്യമാണ്. സിസ്റ്റത്തിൻ്റെ ഈ അവസ്ഥ വലത്തോട്ടോ ഇടത്തോട്ടോ ഉള്ള സന്തുലിതാവസ്ഥയുടെ അതിർത്തിയായി കണക്കാക്കപ്പെടുന്നു. ഒരു പ്രതിപ്രവർത്തനത്തിന് ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം നെഗറ്റീവ് ആകുമ്പോൾ ( ഡി ജി<0 ), പ്രതികരണം മുന്നോട്ടുള്ള ദിശയിൽ മുന്നോട്ട് പോകാമെന്ന് പറയുന്നത് പതിവാണ്; എങ്കിൽ D G>0, പ്രതികരണം ഇല്ലാതാകുന്നില്ലെന്ന് അവർ പറയുന്നു.
അങ്ങനെ,
ഡി ജി<0 - പ്രതികരണം സംഭവിക്കാം (തെർമോഡൈനാമിക്കായി സാധ്യമാണ്);
ഡി ജി<0 , അത് കെ>1- ബാലൻസ് ഉൽപ്പന്നങ്ങളിലേക്ക്, വലത്തേക്ക് മാറ്റുന്നു;
D G>0, അത് TO<1 - സന്തുലിതാവസ്ഥ ആരംഭ പദാർത്ഥങ്ങളിലേക്ക്, ഇടത്തേക്ക് മാറ്റുന്നു.
നിങ്ങൾക്ക് താൽപ്പര്യമുള്ള പ്രതികരണം സാധ്യമാണോ എന്ന് നിങ്ങൾ കണ്ടെത്തേണ്ടതുണ്ടെങ്കിൽ (ഉദാഹരണത്തിന്, ആവശ്യമുള്ള ചായത്തിൻ്റെ സമന്വയം സാധ്യമാണോ എന്ന് കണ്ടെത്തുന്നതിന്, തന്നിരിക്കുന്ന ധാതു ഘടന സിൻ്റർ ചെയ്യുമോ, നിറത്തിൽ അന്തരീക്ഷ ഓക്സിജൻ്റെ പ്രഭാവം മുതലായവ. ), ഈ പ്രതികരണത്തിന് കണക്കാക്കിയാൽ മതി ഡി ജി. ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം നെഗറ്റീവ് ആയി മാറുകയാണെങ്കിൽ, പ്രതികരണം സാധ്യമാണ്, നിങ്ങൾക്ക് ആവശ്യമുള്ള ഉൽപ്പന്നം ലഭിക്കുന്നതിന് വ്യത്യസ്ത പ്രാരംഭ മെറ്റീരിയലുകൾ മിക്സ് ചെയ്യാം.
വ്യത്യസ്ത ഊഷ്മാവിൽ (കണക്കുകൂട്ടൽ അൽഗോരിതം) ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റവും സന്തുലിത സ്ഥിരാങ്കവും കണക്കാക്കാൻ നിങ്ങൾ ചെയ്യേണ്ടത് വായിക്കുക.
1. റഫറൻസ് ടേബിളിൽ നിന്ന് ലളിതമായ പദാർത്ഥങ്ങളിൽ നിന്ന് രൂപപ്പെടുന്ന എൻതാൽപികളുടെ മൂല്യങ്ങൾ (298 കെ താപനിലയ്ക്ക്) എഴുതുക ഡി എൻ ആർ.എൻട്രോപ്പിയും എസ്ഒരു രാസപ്രവർത്തനത്തിൻ്റെ സമവാക്യത്തിൽ എഴുതിയിരിക്കുന്ന എല്ലാ പദാർത്ഥങ്ങളും. എങ്കിൽ ഡി എൻ ആർ. kJ/mol ൽ പ്രകടിപ്പിക്കുന്നു, തുടർന്ന് അവ J/mol ആയി പരിവർത്തനം ചെയ്യണം (എന്തുകൊണ്ട്?).
2. സ്റ്റോയ്ചിയോമെട്രിക് ഗുണകങ്ങളെ ഓർത്ത് ഉൽപന്നങ്ങളുടെ രൂപീകരണത്തിൻ്റെ എന്താൽപികളുടെ ആകെത്തുകയും പ്രാരംഭ പദാർത്ഥങ്ങളുടെ രൂപീകരണത്തിൻ്റെ എൻതാൽപികളുടെ ആകെത്തുകയും തമ്മിലുള്ള വ്യത്യാസമായി പ്രതിപ്രവർത്തനത്തിലെ (298 കെ) എന്താൽപ്പി മാറ്റം കണക്കാക്കുക:
3. പ്രതിപ്രവർത്തനത്തിലെ എൻട്രോപ്പിയിലെ മാറ്റം (298 കെ) ഉൽപന്നങ്ങളുടെ എൻട്രോപികളുടെ ആകെത്തുകയും ആരംഭ പദാർത്ഥങ്ങളുടെ എൻട്രോപികളുടെ ആകെത്തുകയും തമ്മിലുള്ള വ്യത്യാസമായി കണക്കാക്കുക, സ്റ്റോയ്ചിയോമെട്രിക് ഗുണകങ്ങൾ ഓർമ്മിക്കുക:
4. പ്രതിപ്രവർത്തനം, എൻട്രോപ്പി, താപനില എന്നിവയുടെ എൻതാൽപ്പിയിലെ മാറ്റങ്ങളെ അടിസ്ഥാനമാക്കിയുള്ള ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റത്തെ ആശ്രയിക്കുന്നതിനുള്ള ഒരു സമവാക്യം ഉണ്ടാക്കുക, ഇപ്പോൾ ലഭിച്ച സംഖ്യാ മൂല്യങ്ങൾ നിങ്ങൾക്ക് അറിയാവുന്ന സമവാക്യത്തിലേക്ക് മാറ്റിസ്ഥാപിക്കുക. ഡി എൻ ആർ-ഷൻഒപ്പം ഡി എസ് ജില്ലകൾ:
5. 298 കെ എന്ന സാധാരണ താപനിലയിൽ ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം കണക്കാക്കുക:
6. അടയാളം വഴി ഡി ജി ജില്ലകൾ, 298 ഒരു സ്റ്റാൻഡേർഡ് താപനിലയിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനത്തിൻ്റെ സാധ്യതയെക്കുറിച്ച് ഒരു നിഗമനത്തിലെത്തുക: അടയാളം "മൈനസ്" ആണെങ്കിൽ, പ്രതികരണം തെർമോഡൈനാമിക് ആയി സാധ്യമാണ്; അടയാളം "പ്ലസ്" ആണെങ്കിൽ, പ്രതികരണം അസാധ്യമാണ്.
7. ഗണിതം ചെയ്യുക ഡി ജി ജില്ലകൾ T താപനിലയിൽ നിങ്ങൾക്ക് താൽപ്പര്യമുണ്ട്:
താപനിലയിലെ മാറ്റം ഒരു പ്രതികരണത്തിൻ്റെ സാധ്യതയെ എങ്ങനെ ബാധിക്കുന്നു എന്നതിനെക്കുറിച്ച് ഒരു നിഗമനത്തിലെത്തുക. ഈ താപനിലയിൽ ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം പോസിറ്റീവ് അല്ലെങ്കിൽ കൂടുതൽ നെഗറ്റീവ് ആയി മാറിയെന്ന് ഡി ജി 298, അതിനാൽ, ഈ താപനിലയിൽ പ്രതികരണം കൂടുതൽ സാധ്യതയുണ്ട്.
8. നിങ്ങൾക്ക് താൽപ്പര്യമുള്ള T താപനിലയിൽ നിങ്ങൾക്കറിയാവുന്ന സമവാക്യത്തിൽ നിന്ന് സന്തുലിത സ്ഥിരമായ K കണക്കാക്കുക:
9. ആരംഭ പദാർത്ഥങ്ങളിലേക്കുള്ള സന്തുലിതാവസ്ഥയുടെ മാറ്റത്തെക്കുറിച്ച് ഒരു നിഗമനത്തിലെത്തുക (കെ<1) или в сторону продуктов (К>1).
ഐസോബാറിക് പൊട്ടൻഷ്യലിൽ നെഗറ്റീവ് മാറ്റത്തോടെ ഒരു പ്രതികരണം ഉണ്ടാകാനുള്ള സാധ്യതയെക്കുറിച്ച് നിഗമനം ചെയ്യാൻ ( ഡി ജി ജില്ലകൾ<0 ) തെർമോഡൈനാമിക് ഡാറ്റ മാത്രം പലപ്പോഴും അപര്യാപ്തമാണ്. സാഹചര്യങ്ങൾ മാറുമ്പോൾ (പദാർത്ഥങ്ങളുടെ സാന്ദ്രത, മർദ്ദം, താപനില), മറ്റ് പ്രതിപ്രവർത്തന പാതകളിലൂടെയോ ശരിയായി തിരഞ്ഞെടുത്ത കാറ്റലിസ്റ്റിൻ്റെ സാന്നിധ്യത്തിലോ തെർമോഡൈനാമിക് ആയി സാധ്യമായ ഒരു പ്രതികരണം ചലനാത്മകമായി നിരോധിതവും പ്രായോഗികവുമാകാം.
വാതക ജലവുമായി (ജല നീരാവി) ക്രിസ്റ്റലിൻ ഇരുമ്പിൻ്റെ പ്രതിപ്രവർത്തനത്തിൻ്റെ ഉദാഹരണം നമുക്ക് പരിഗണിക്കാം:
ഒരു പ്രതികരണത്തിൻ്റെ തെർമോഡൈനാമിക് സാധ്യതയെക്കുറിച്ച് എങ്ങനെ കണ്ടെത്താം.
ഈ പ്രതികരണം രസകരമാണ്, കാരണം ഇത് ഒരു ലോഹ ഉൽപന്നത്തിൻ്റെ തിളക്കം കുറയുന്നതിനും നാശത്തിൽ നിന്ന് നശിപ്പിക്കുന്നതിനുമുള്ള കാരണങ്ങൾ കാണിക്കുന്നു.
ഒന്നാമതായി, പ്രതികരണ സമവാക്യത്തിൻ്റെ സ്റ്റോയിയോമെട്രിക് ഗുണകങ്ങൾ ഞങ്ങൾ തിരഞ്ഞെടുക്കുന്നു:
റഫറൻസ് ടേബിളിൽ നിന്നുള്ള പ്രതികരണത്തിൽ പങ്കെടുക്കുന്ന എല്ലാവർക്കും തെർമോഡൈനാമിക് ഡാറ്റ (താപനില 298 കെ) എഴുതാം:

ഈ പ്രതിപ്രവർത്തനത്തിലെ എൻതാൽപ്പിയിലെ മാറ്റം നമുക്ക് കണക്കാക്കാം, ലളിതമായ പദാർത്ഥങ്ങളുടെ എൻതാൽപികൾ പൂജ്യത്തിന് തുല്യമാണെന്ന് ഓർമ്മിക്കുക:

ജെയിൽ എൻതാൽപ്പിയിലെ മാറ്റം നമുക്ക് പ്രകടിപ്പിക്കാം:
പ്രതികരണത്തോടൊപ്പം താപം, Q>0, Q=+50 300 J/mol എന്നിവ പുറത്തുവരുന്നു, ഇത് സ്വയമേവ സംഭവിക്കുന്നുവെന്ന് അനുമാനിക്കാൻ ഇത് സാധ്യമാക്കുന്നു. എന്നിരുന്നാലും, ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റത്തിൻ്റെ അടയാളത്താൽ മാത്രമേ പ്രതികരണം സ്വയമേവയുള്ളതാണെന്ന് ഒരാൾക്ക് ആത്മവിശ്വാസത്തോടെ പറയാൻ കഴിയും.
ഈ പ്രതികരണത്തിലെ എൻട്രോപ്പിയിലെ മാറ്റം നമുക്ക് കണക്കാക്കാം, സ്റ്റോയിയോമെട്രിക് ഗുണകങ്ങളെക്കുറിച്ച് മറക്കരുത്:

പ്രതികരണത്തിൻ്റെ ഫലമായി സിസ്റ്റത്തിൻ്റെ എൻട്രോപ്പി കുറയുന്നു, അതിനാൽ സിസ്റ്റത്തിൽ ക്രമത്തിൽ വർദ്ധനവ് സംഭവിക്കുന്നത് ശ്രദ്ധിക്കാം.
എൻതാൽപ്പി, എൻട്രോപ്പി, താപനില എന്നിവയിലെ മാറ്റങ്ങളെ അടിസ്ഥാനമാക്കിയുള്ള ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റങ്ങളെ ആശ്രയിക്കുന്നതിനുള്ള ഒരു സമവാക്യം നമുക്ക് ഇപ്പോൾ സൃഷ്ടിക്കാം:
298 കെ എന്ന സ്റ്റാൻഡേർഡ് താപനിലയിൽ പ്രതിപ്രവർത്തനത്തിലെ ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം നമുക്ക് കണക്കാക്കാം:
ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റത്തിൻ്റെ ഉയർന്ന നെഗറ്റീവ് മൂല്യം സൂചിപ്പിക്കുന്നത്, ഊഷ്മാവിൽ ഇരുമ്പ് ഓക്സിജൻ ഉപയോഗിച്ച് ഓക്സിഡൈസ് ചെയ്യപ്പെടുമെന്ന്. നിങ്ങൾക്ക് ഏറ്റവും മികച്ച ഇരുമ്പ് പൊടി ലഭിക്കുകയാണെങ്കിൽ, ഇരുമ്പ് വായുവിൽ എങ്ങനെ കത്തുന്നുവെന്ന് നിങ്ങൾ കാണും. എന്തുകൊണ്ട് ഇരുമ്പ് ഉൽപ്പന്നങ്ങൾ, പ്രതിമകൾ, നഖങ്ങൾ മുതലായവ വായുവിൽ കത്തുന്നില്ല? കണക്കുകൂട്ടൽ ഫലങ്ങൾ കാണിക്കുന്നത് ഇരുമ്പ് വായുവിൽ തുരുമ്പെടുക്കുന്നു, അതായത്, അത് നശിപ്പിക്കപ്പെടുകയും ഇരുമ്പ് ഓക്സൈഡുകളായി മാറുകയും ചെയ്യുന്നു.
താപനില വർദ്ധിക്കുന്നത് ഈ പ്രതികരണത്തിൻ്റെ സാധ്യതയെ എങ്ങനെ ബാധിക്കുന്നു എന്ന് നോക്കാം. 500 കെ താപനിലയിൽ ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം നമുക്ക് കണക്കാക്കാം:
താപനില കൂടുന്നതിനനുസരിച്ച്, പ്രതിപ്രവർത്തനത്തിൻ്റെ ഐസോബാറിക് പൊട്ടൻഷ്യലിലെ മാറ്റം നെഗറ്റീവ് ആയി മാറുന്നുവെന്ന് കാണിക്കുന്ന ഒരു ഫലം ഞങ്ങൾക്ക് ലഭിച്ചു. ഇതിനർത്ഥം, താപനില വർദ്ധിക്കുന്നതിനനുസരിച്ച് പ്രതിപ്രവർത്തനം തെർമോഡൈനാമിക് ആയി കുറയുന്നു, അതായത് പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിതാവസ്ഥ ആരംഭിക്കുന്ന പദാർത്ഥങ്ങളിലേക്ക് കൂടുതൽ കൂടുതൽ മാറുന്നു.
ഏത് താപനിലയിലാണ് സന്തുലിതാവസ്ഥ പ്രതികരണ ഉൽപ്പന്നങ്ങളിലേക്കും ആരംഭ പദാർത്ഥങ്ങളിലേക്കും തുല്യമായി മാറുന്നതെന്ന് അറിയുന്നത് രസകരമാണ്. എപ്പോഴാണ് ഇത് സംഭവിക്കുന്നത് D G r-tion =0(സന്തുലിത സ്ഥിരാങ്കം 1 ആണ്):
നമുക്ക് അത് എവിടെ നിന്ന് ലഭിക്കും:
T=150300/168.2=894K, അഥവാ 621° സെ.
ഈ ഊഷ്മാവിൽ, പ്രതികരണം മുന്നിലേക്കും വിപരീത ദിശയിലേക്കും ഒരുപോലെ സംഭവിക്കാൻ സാധ്യതയുണ്ട്. 621 ഡിഗ്രി സെൽഷ്യസിനു മുകളിലുള്ള താപനിലയിൽ, ഹൈഡ്രജനുമായി Fe 3 O 4 കുറയ്ക്കുന്നതിൻ്റെ വിപരീത പ്രതികരണം പ്രബലമാകാൻ തുടങ്ങുന്നു. ഈ പ്രതികരണം ശുദ്ധമായ ഇരുമ്പ് ലഭിക്കുന്നതിനുള്ള ഒരു വഴിയാണ് (ലോഹശാസ്ത്രത്തിൽ, കാർബണിനൊപ്പം ഇരുമ്പ് ഓക്സൈഡുകൾ കുറയുന്നു).
298 കെ താപനിലയിൽ:



അങ്ങനെ, താപനില വർദ്ധിക്കുന്നതിനനുസരിച്ച്, സന്തുലിത സ്ഥിരത കുറയുന്നു.
അയൺ ഓക്സൈഡ് Fe 3 O 4 മാഗ്നെറ്റൈറ്റ് (കാന്തിക ഇരുമ്പ് അയിര്) എന്ന് വിളിക്കുന്നു. ഈ ഇരുമ്പ് ഓക്സൈഡ്, FeO (wüstite), Fe 2 O 3 (ഹെമറ്റൈറ്റ്) എന്നീ ഓക്സൈഡുകളിൽ നിന്ന് വ്യത്യസ്തമായി, ഒരു കാന്തത്താൽ ആകർഷിക്കപ്പെടുന്നു. പുരാതന കാലത്ത് മാഗ്നസ് എന്ന ഇടയൻ വളരെ ചെറിയ ദീർഘചതുരാകൃതിയിലുള്ള ഒരു ഉരുളൻ കല്ല് കണ്ടെത്തിയതായി ഒരു ഐതിഹ്യം ഉണ്ട്, അത് തൻ്റെ കൊഴുപ്പ് (എന്തുകൊണ്ട് ഇത് പ്രധാനമാണ്?) കൈകളാൽ ഒരു പാത്രത്തിൽ വെള്ളത്തിൻ്റെ ഉപരിതലത്തിൽ സ്ഥാപിച്ചു. ഉരുളൻ കല്ല് മുങ്ങാതെ വെള്ളത്തിൽ പൊങ്ങിക്കിടക്കാൻ തുടങ്ങി, ഇടയൻ പാത്രം എങ്ങനെ തിരിച്ചിട്ടുണ്ടെങ്കിലും, കല്ല് എല്ലായ്പ്പോഴും ഒരു ദിശയിലേക്ക് മാത്രം ചൂണ്ടിക്കാണിച്ചു. കോമ്പസ് കണ്ടുപിടിച്ചത് ഇങ്ങനെയാണ്, ഈ ഇടയൻ്റെ പേരിൽ നിന്നാണ് ധാതുവിന് അതിൻ്റെ പേര് ലഭിച്ചത്. എന്നിരുന്നാലും, ഒരുപക്ഷേ, മാഗ്നറ്റൈറ്റിന് പുരാതന നഗരമായ ഏഷ്യാമൈനറിൻ്റെ പേരാണ് നൽകിയിരിക്കുന്നത് - മഗ്നീഷ്യ. ഇരുമ്പ് വേർതിരിച്ചെടുക്കുന്ന പ്രധാന അയിര് മാഗ്നറ്റൈറ്റ് ആണ്.
ചിലപ്പോൾ മാഗ്നറ്റൈറ്റ് ഫോർമുല ഇനിപ്പറയുന്ന രീതിയിൽ ചിത്രീകരിച്ചിരിക്കുന്നു: FeO Fe 2 O 3, മാഗ്നറ്റൈറ്റിൽ രണ്ട് അയൺ ഓക്സൈഡുകൾ അടങ്ങിയിരിക്കുന്നുവെന്ന് സൂചിപ്പിക്കുന്നു. ഇത് തെറ്റാണ്: മാഗ്നറ്റൈറ്റ് ഒരു വ്യക്തിഗത പദാർത്ഥമാണ്.
Fe 2 O 3 (ഹെമറ്റൈറ്റ്) ൻ്റെ മറ്റൊരു ഓക്സൈഡ് - ചുവന്ന ഇരുമ്പ് അയിര് - അതിൻ്റെ ചുവന്ന നിറം (ഗ്രീക്കിൽ നിന്നുള്ള വിവർത്തനത്തിൽ - രക്തം) കാരണം ഈ പേര് ലഭിച്ചു. ഹെമറ്റൈറ്റിൽ നിന്നാണ് ഇരുമ്പ് ലഭിക്കുന്നത്.
FeO ഓക്സൈഡ് ഒരിക്കലും പ്രകൃതിയിൽ കാണപ്പെടുന്നില്ല, വ്യാവസായിക പ്രാധാന്യവുമില്ല.
ഒരു പ്രതിപ്രവർത്തനത്തിൻ്റെ ദിശയും പദാർത്ഥങ്ങളുടെ സാന്ദ്രതയിലെ മാറ്റവും കാണിക്കുന്ന ഒരു അളവ് സ്വഭാവത്തെ ഒരു രാസപ്രവർത്തനത്തിൻ്റെ സന്തുലിത സ്ഥിരാങ്കം എന്ന് വിളിക്കുന്നു. സന്തുലിത സ്ഥിരാങ്കം താപനിലയെയും റിയാക്ടറുകളുടെ സ്വഭാവത്തെയും ആശ്രയിച്ചിരിക്കുന്നു.
വിപരീതവും മാറ്റാനാവാത്തതുമായ പ്രതികരണങ്ങൾ
എല്ലാ പ്രതികരണങ്ങളെയും രണ്ട് തരങ്ങളായി തിരിക്കാം:
- തിരിച്ചുള്ള, ഒരേസമയം രണ്ട് വിപരീത ദിശകളിലേക്ക് ഒഴുകുന്നു;
- മാറ്റാനാവാത്ത, കുറഞ്ഞത് ഒരു ആരംഭ പദാർത്ഥത്തിൻ്റെ പൂർണ്ണമായ ഉപഭോഗം ഉപയോഗിച്ച് ഒരു ദിശയിലേക്ക് ഒഴുകുന്നു.
മാറ്റാനാവാത്ത പ്രതിപ്രവർത്തനങ്ങൾ സാധാരണയായി ഒരു അവശിഷ്ടത്തിൻ്റെയോ വാതകത്തിൻ്റെയോ രൂപത്തിൽ ലയിക്കാത്ത പദാർത്ഥങ്ങൾ ഉത്പാദിപ്പിക്കുന്നു. അത്തരം പ്രതികരണങ്ങളിൽ ഇവ ഉൾപ്പെടുന്നു:
- ജ്വലനം:
C 2 H 5 OH + 3O 2 → 2CO 2 + H 2 O;
- വിഘടനം:
2KMnO 4 → K 2 MnO 4 + MnO 2 + H 2 O;
- അവശിഷ്ടത്തിൻ്റെയോ വാതകത്തിൻ്റെയോ രൂപീകരണവുമായുള്ള ബന്ധം:
BaCl 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaCl.

അരി. 1. BaSO 4 അവശിഷ്ടത്തിൻ്റെ രൂപീകരണം.
ചില സ്ഥിരമായ സാഹചര്യങ്ങളിൽ മാത്രമേ വിപരീത പ്രതികരണങ്ങൾ സാധ്യമാകൂ. യഥാർത്ഥ പദാർത്ഥങ്ങൾ ഒരു പുതിയ പദാർത്ഥത്തിന് കാരണമാകുന്നു, അത് ഉടനടി അതിൻ്റെ ഘടകഭാഗങ്ങളായി വിഘടിക്കുകയും വീണ്ടും കൂട്ടിച്ചേർക്കുകയും ചെയ്യുന്നു. ഉദാഹരണത്തിന്, 2NO + O 2 ↔ 2NO 2 പ്രതികരണത്തിൻ്റെ ഫലമായി, നൈട്രിക് ഓക്സൈഡ് (IV) എളുപ്പത്തിൽ നൈട്രിക് ഓക്സൈഡിലേക്കും (II) ഓക്സിജനിലേക്കും വിഘടിക്കുന്നു.
സന്തുലിതാവസ്ഥ
ഒരു നിശ്ചിത സമയത്തിനുശേഷം, റിവേഴ്സിബിൾ പ്രതികരണത്തിൻ്റെ നിരക്ക് കുറയുന്നു. രാസ സന്തുലിതാവസ്ഥ കൈവരിക്കുന്നു - കാലക്രമേണ ആരംഭ പദാർത്ഥങ്ങളുടെയും പ്രതികരണ ഉൽപ്പന്നങ്ങളുടെയും സാന്ദ്രതയിൽ മാറ്റമില്ലാത്ത അവസ്ഥ, കാരണം മുന്നോട്ട്, വിപരീത പ്രതികരണങ്ങളുടെ നിരക്ക് തുല്യമാണ്. ഏകതാനമായ സംവിധാനങ്ങളിൽ മാത്രമേ സന്തുലിതാവസ്ഥ സാധ്യമാകൂ, അതായത്, പ്രതികരിക്കുന്ന എല്ലാ വസ്തുക്കളും ദ്രാവകങ്ങളോ വാതകങ്ങളോ ആണ്.
അയോഡിനുമായുള്ള ഹൈഡ്രജൻ്റെ പ്രതിപ്രവർത്തനത്തിൻ്റെ ഉദാഹരണം ഉപയോഗിച്ച് നമുക്ക് രാസ സന്തുലിതാവസ്ഥ പരിഗണിക്കാം:
- നേരിട്ടുള്ള പ്രതികരണം -
H 2 + I 2 ↔ 2HI;
- തിരിച്ചടി -
2HI ↔ H 2 + I 2 .
ഹൈഡ്രജൻ, അയോഡിൻ - ഹൈഡ്രജൻ അയഡൈഡ് എന്ന രണ്ട് ഘടകങ്ങളും കൂടിച്ചേർന്ന ഉടൻ, ലളിതമായ പദാർത്ഥങ്ങൾ മാത്രമേ പ്രതിപ്രവർത്തിക്കുന്നുള്ളൂ എന്നതിനാൽ. ധാരാളം ആരംഭ പദാർത്ഥങ്ങൾ പരസ്പരം സജീവമായി പ്രതികരിക്കുന്നു, അതിനാൽ നേരിട്ടുള്ള പ്രതികരണത്തിൻ്റെ വേഗത പരമാവധി ആയിരിക്കും. ഈ സാഹചര്യത്തിൽ, വിപരീത പ്രതികരണം സംഭവിക്കുന്നില്ല, അതിൻ്റെ വേഗത പൂജ്യമാണ്.
ഫോർവേഡ് പ്രതികരണത്തിൻ്റെ നിരക്ക് ഗ്രാഫിക്കായി പ്രകടിപ്പിക്കാം:
ν pr = k pr ∙ ∙,
ഇവിടെ k pr എന്നത് നേരിട്ടുള്ള പ്രതികരണത്തിൻ്റെ നിരക്ക് സ്ഥിരാങ്കമാണ്.
കാലക്രമേണ, റിയാക്ടറുകൾ ഉപഭോഗം ചെയ്യപ്പെടുകയും അവയുടെ സാന്ദ്രത കുറയുകയും ചെയ്യുന്നു. അതനുസരിച്ച്, ഫോർവേഡ് പ്രതികരണത്തിൻ്റെ നിരക്ക് കുറയുന്നു. അതേ സമയം, ഹൈഡ്രജൻ അയോഡൈഡ് എന്ന പുതിയ പദാർത്ഥത്തിൻ്റെ സാന്ദ്രത വർദ്ധിക്കുന്നു. കുമിഞ്ഞുകൂടുമ്പോൾ, അത് വിഘടിപ്പിക്കാൻ തുടങ്ങുന്നു, വിപരീത പ്രതികരണത്തിൻ്റെ നിരക്ക് വർദ്ധിക്കുന്നു. എന്ന് പ്രകടിപ്പിക്കാം
ν arr = k arr ∙ 2 .
തന്മാത്രയുടെ ഗുണകം രണ്ടായതിനാൽ ഹൈഡ്രജൻ അയഡൈഡ് ചതുരാകൃതിയിലാണ്.
ഒരു നിശ്ചിത ഘട്ടത്തിൽ, മുന്നോട്ട്, വിപരീത പ്രതികരണങ്ങളുടെ നിരക്ക് തുല്യമാകും. ഒരു രാസ സന്തുലിതാവസ്ഥ സംഭവിക്കുന്നു.

അരി. 2. പ്രതികരണ വേഗതയും സമയവും തമ്മിലുള്ള ഗ്രാഫ്.
സമതുലിതാവസ്ഥ ആരംഭിക്കുന്ന മെറ്റീരിയലുകളിലേക്കോ പ്രതികരണ ഉൽപ്പന്നങ്ങളിലേക്കോ മാറ്റാം. ബാഹ്യ ഘടകങ്ങളുടെ സ്വാധീനത്തിൻ കീഴിലുള്ള സ്ഥാനചലനത്തെ Le Chatelier ൻ്റെ തത്വം എന്ന് വിളിക്കുന്നു. സന്തുലിതാവസ്ഥയെ താപനില, മർദ്ദം, പദാർത്ഥങ്ങളിലൊന്നിൻ്റെ സാന്ദ്രത എന്നിവ ബാധിക്കുന്നു.
സ്ഥിരമായ കണക്കുകൂട്ടൽ
സന്തുലിതാവസ്ഥയിൽ, രണ്ട് പ്രതിപ്രവർത്തനങ്ങളും സംഭവിക്കുന്നു, എന്നാൽ അതേ സമയം പദാർത്ഥങ്ങളുടെ സാന്ദ്രത സന്തുലിതാവസ്ഥയിലാണ് (സന്തുലിത സാന്ദ്രത രൂപപ്പെടുന്നു), കാരണം നിരക്ക് സന്തുലിതമാണ് (ν pr = ν arr).
കെമിക്കൽ സന്തുലിതാവസ്ഥയെ ഒരു കെമിക്കൽ സന്തുലിത സ്ഥിരാങ്കത്തിൻ്റെ സവിശേഷതയാണ്, ഇത് സംഗ്രഹ ഫോർമുലയാൽ പ്രകടിപ്പിക്കുന്നു:
K p = k pr / k arr = const.
പ്രതികരണ നിരക്ക് സ്ഥിരാങ്കങ്ങൾ പ്രതികരണ നിരക്ക് അനുപാതത്തിൽ പ്രകടിപ്പിക്കാം. വിപരീത പ്രതികരണത്തിൻ്റെ സോപാധിക സമവാക്യം നമുക്ക് എടുക്കാം:
aA + bB ↔ cC + dD.
അപ്പോൾ ഫോർവേഡ്, റിവേഴ്സ് പ്രതികരണങ്ങളുടെ നിരക്ക് തുല്യമായിരിക്കും:
- ν pr = k pr ∙ [A] p a ∙ [B] p b
- ν arr = k arr ∙ [C] p c ∙ [D] p d .
അതനുസരിച്ച്, എങ്കിൽ
ν pr = ν arr,
k pr ∙ [A] p a ∙ [B] p b = k arr ∙ [C] p c ∙ [D] p d.
ഇവിടെ നിന്ന് നമുക്ക് സ്ഥിരാങ്കങ്ങളുടെ ബന്ധം പ്രകടിപ്പിക്കാം:
k arr / k pr = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .
ഈ അനുപാതം സന്തുലിത സ്ഥിരാങ്കത്തിന് തുല്യമാണ്:
K p = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .

അരി. 3. സന്തുലിത സ്ഥിരാങ്കത്തിനുള്ള ഫോർമുല.
റിവേഴ്സ് റിയാക്ഷൻ്റെ നിരക്കിനേക്കാൾ എത്ര മടങ്ങ് ഫോർവേഡ് പ്രതികരണത്തിൻ്റെ നിരക്ക് കൂടുതലാണെന്ന് മൂല്യം കാണിക്കുന്നു.
നമ്മൾ എന്താണ് പഠിച്ചത്?
അന്തിമ ഉൽപ്പന്നങ്ങളെ ആശ്രയിച്ച്, പ്രതികരണങ്ങളെ റിവേഴ്സിബിൾ, റിവേഴ്സിബിൾ എന്നിങ്ങനെ തിരിച്ചിരിക്കുന്നു. റിവേഴ്സിബിൾ പ്രതികരണങ്ങൾ രണ്ട് ദിശകളിലേക്കും തുടരുന്നു: ആരംഭ പദാർത്ഥങ്ങൾ അന്തിമ ഉൽപ്പന്നങ്ങളായി മാറുന്നു, അത് ആരംഭ പദാർത്ഥങ്ങളായി വിഘടിക്കുന്നു. പ്രതികരണ സമയത്ത്, മുന്നോട്ടും വിപരീത പ്രതികരണങ്ങളുടേയും നിരക്ക് സന്തുലിതമാണ്. ഈ അവസ്ഥയെ രാസ സന്തുലിതാവസ്ഥ എന്ന് വിളിക്കുന്നു. പ്രതിപ്രവർത്തന ഉൽപന്നങ്ങളുടെ സന്തുലിത സാന്ദ്രതയുടെയും ആരംഭ പദാർത്ഥങ്ങളുടെ സന്തുലിത സാന്ദ്രതയുടെയും ഉൽപ്പന്നത്തിൻ്റെ അനുപാതമായി ഇത് പ്രകടിപ്പിക്കാം.
വിഷയത്തിൽ പരീക്ഷിക്കുക
റിപ്പോർട്ടിൻ്റെ വിലയിരുത്തൽ
ശരാശരി റേറ്റിംഗ്: 4.8 ആകെ ലഭിച്ച റേറ്റിംഗുകൾ: 64.
ചില സന്ദർഭങ്ങളിൽ, റെഡോക്സ് പ്രതികരണത്തിൻ്റെ ദിശ മാത്രമല്ല, അത് എത്ര പൂർണ്ണമായി മുന്നോട്ട് പോകുന്നുവെന്നും അറിയേണ്ടത് ആവശ്യമാണ്. ഉദാഹരണത്തിന്, ക്വാണ്ടിറ്റേറ്റീവ് വിശകലനത്തിൽ, നിങ്ങൾക്ക് പ്രായോഗികമായി 100% (അല്ലെങ്കിൽ അതിനോട് അടുത്ത്) തുടരുന്ന പ്രതികരണങ്ങളെ മാത്രമേ ആശ്രയിക്കാൻ കഴിയൂ.
ഒരു പ്രതിപ്രവർത്തനം ഇടത്തുനിന്ന് വലത്തോട്ട് നീങ്ങുന്നതിൻ്റെ അളവ് നിർണ്ണയിക്കുന്നത് സന്തുലിത സ്ഥിരാങ്കമാണ്. പ്രതികരണത്തിനായി
ബഹുജന പ്രവർത്തന നിയമമനുസരിച്ച്, നമുക്ക് എഴുതാം:
![]()
ഇവിടെ K എന്നത് സന്തുലിത സ്ഥിരാങ്കമാണ്, അയോണുകളുടെ സാന്ദ്രതയും സന്തുലിതാവസ്ഥയും തമ്മിലുള്ള ബന്ധം എന്താണ് എന്ന് കാണിക്കുന്നു.
സന്തുലിത സ്ഥിരാങ്കം ഇനിപ്പറയുന്ന രീതിയിൽ നിർണ്ണയിക്കപ്പെടുന്നു. സമവാക്യത്തിൽ (3) (പേജ് 152) ജോഡികളുടെ സാധാരണ സാധ്യതകളുടെ മൂല്യങ്ങൾ മാറ്റിസ്ഥാപിച്ച് കണ്ടെത്തുക:

സന്തുലിതാവസ്ഥയിൽ = അല്ലെങ്കിൽ


ലായനിയിലെ അയോണുകളുടെ സാന്ദ്രത അയോണുകളുടെ സാന്ദ്രതയേക്കാൾ ഒരു മടങ്ങ് കുറയുന്നതുവരെ സിങ്ക് ലായനിയിൽ നിന്ന് കോപ്പർ അയോണുകളെ സ്ഥാനഭ്രഷ്ടനാക്കുന്നു എന്ന് സന്തുലിത സ്ഥിരാങ്കം കാണിക്കുന്നു. ഇതിനർത്ഥം ചോദ്യം ചെയ്യപ്പെടുന്ന പ്രതികരണം ഏതാണ്ട് പൂർത്തിയായി എന്നാണ്.
ഉദാഹരണത്തിന്, പ്രതികരണത്തിൻ്റെ തുടക്കത്തിലെ സാന്ദ്രത 0.1 മീ ആണെങ്കിൽ, സന്തുലിതാവസ്ഥയിൽ അത് 0.1 - x ആയിരിക്കും, അതേസമയം സാന്ദ്രത x ആയിരിക്കും.
സമവാക്യം പരിഹരിക്കുമ്പോൾ, സന്തുലിതാവസ്ഥയിലെ സാന്ദ്രത 0.1 മീറ്ററിനോട് വളരെ അടുത്താണ്.
എന്നിരുന്നാലും, സംവദിക്കുന്ന ഘടകങ്ങളുടെ അനുപാതം മാറ്റാൻ കഴിയുമെങ്കിൽ, അത് മാറുന്നു, അതായത്. അല്ലെങ്കിൽ പ്രതികരണം വലത്തുനിന്ന് ഇടത്തോട്ട് (അതായത് എതിർദിശയിൽ) പോകും.
പ്രത്യേക പ്രതിപ്രവർത്തനങ്ങളുടെ റെഡോക്സ് സാധ്യതകൾ അറിയാമെങ്കിൽ ഏതെങ്കിലും റെഡോക്സ് പ്രക്രിയകൾക്കുള്ള സന്തുലിത സ്ഥിരാങ്കം കണക്കാക്കാം.
സന്തുലിത സ്ഥിരാങ്കം പൊതു ഫോർമുല പ്രകാരം റെഡോക്സ് പൊട്ടൻഷ്യലുകളുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു:

ഇവിടെ K എന്നത് പ്രതിപ്രവർത്തന സന്തുലിത സ്ഥിരാങ്കമാണ്; സാധാരണ സാധ്യതകളും (ഓക്സിഡൈസറും റിഡ്യൂസറും); n എന്നത് അയോണുകളുടെ ചാർജാണ് (കുറയ്ക്കുന്ന ഏജൻ്റ് ഉപേക്ഷിക്കുകയും ഓക്സിഡൈസിംഗ് ഏജൻ്റ് സ്വീകരിക്കുകയും ചെയ്യുന്ന ഇലക്ട്രോണുകളുടെ എണ്ണം).
ഫോർമുലയിൽ നിന്ന് (4) നമ്മൾ സന്തുലിത സ്ഥിരാങ്കം കണ്ടെത്തുന്നു:

സന്തുലിത സ്ഥിരാങ്കം അറിയുന്നതിലൂടെ, പരീക്ഷണാത്മക ഡാറ്റ അവലംബിക്കാതെ, പ്രതികരണം എത്രത്തോളം പൂർണ്ണമായി തുടരുന്നുവെന്ന് കണക്കാക്കാൻ കഴിയും.
അതിനാൽ, ഉദാഹരണത്തിന്, പ്രതികരണത്തിൽ
ഒരു ജോഡിക്ക് = -0.126 V, ഒരു ജോഡിക്ക് = -0.136 V.
ഈ ഡാറ്റ സമവാക്യത്തിലേക്ക് (4) പകരം വയ്ക്കുന്നത്, ഞങ്ങൾ കണ്ടെത്തുന്നത്:
![]()
2.21 എന്ന സംഖ്യ അർത്ഥമാക്കുന്നത്, അയോൺ സാന്ദ്രത അയോൺ സാന്ദ്രതയേക്കാൾ 2.21 മടങ്ങ് കുറയുമ്പോൾ പരിഗണിക്കപ്പെടുന്ന പ്രതിപ്രവർത്തനത്തിലെ സന്തുലിതാവസ്ഥ സംഭവിക്കുന്നു എന്നാണ്.
സന്തുലിതാവസ്ഥയിലുള്ള അയോണിൻ്റെ സാന്ദ്രത അയോൺ സാന്ദ്രതയുടെ 2.21 മടങ്ങാണ്. അതിനാൽ, ഓരോ 2.21 ഗ്രാം അയോണിലും 1 ഗ്രാം അയോൺ ഉണ്ട്. മൊത്തത്തിൽ, ലായനിയിൽ 3.21 ഗ്രാം അയോണുകൾ (2.21 + 1) അടങ്ങിയിരിക്കുന്നു. അങ്ങനെ, ലായനിയിലെ ഓരോ 3.21 ഗ്രാം അയോണുകളിലും 2.21 ഗ്രാം അയോണുകൾ ഉണ്ട്, 100 ഭാഗങ്ങൾക്ക് x ഭാഗങ്ങൾ ഉണ്ടാകും.

അതിനാൽ, ഈ പ്രതികരണം വിപരീതമായി തുടരുന്നു. പ്രതികരണത്തിനുള്ള സന്തുലിത സ്ഥിരാങ്കം നമുക്ക് കണക്കാക്കാം:
ഒരു ജോഡിയുടെ സാധ്യത = 1.51 V, ഒരു ജോഡിയുടെ സാധ്യത = 0.77 V. ഈ സാധ്യതയുള്ള മൂല്യങ്ങളെ സമവാക്യത്തിലേക്ക് (4) മാറ്റിസ്ഥാപിക്കുമ്പോൾ, ഞങ്ങൾ കണ്ടെത്തുന്നത്:

ന്യൂമറേറ്ററിലെ അയോണുകളുടെ സാന്ദ്രതയുടെ ഗുണനഫലം (പ്രതികരണ സമയത്ത് രൂപം കൊള്ളുന്നു) ഡിനോമിനേറ്റർ അയോണുകളുടെ (പ്രതികരണം) സാന്ദ്രതയുടെ ഗുണനത്തേക്കാൾ പലമടങ്ങ് വലുതാകുമ്പോൾ സന്തുലിതാവസ്ഥ സംഭവിക്കുന്നുവെന്ന് ഈ സ്ഥിരാങ്കം കാണിക്കുന്നു.
ഈ പ്രതികരണം ഏതാണ്ട് മാറ്റാനാകാത്ത വിധത്തിൽ (അതായത്, ഇടത്തുനിന്ന് വലത്തോട്ട് 100%) മുന്നോട്ട് പോകുന്നുവെന്ന് വ്യക്തമാണ്.
പ്രതികരണത്തിനായി
ഒരു കണക്കുകൂട്ടൽ (മുകളിൽ പറഞ്ഞതിന് സമാനമായത്) ഈ പ്രതികരണം സംഭവിക്കുന്നത് കാണിക്കുന്നു.
പ്രതികരണ സാഹചര്യങ്ങളെ ആശ്രയിച്ച് സന്തുലിതാവസ്ഥ മാറുന്നു.
മാധ്യമത്തിൻ്റെ പ്രതികരണം സ്ഥിരാങ്കത്തിൻ്റെ മൂല്യത്തിൽ അസാധാരണമായ സ്വാധീനം ചെലുത്തുന്നു. ഉദാഹരണത്തിന്, ഒരു അസിഡിക് മീഡിയത്തിൽ അയോഡിൻ അയോണുമായി ആർസെനിക് ആസിഡ് കുറയ്ക്കുന്നതിൻ്റെ പ്രതികരണം സമവാക്യം അനുസരിച്ച് തുടരുന്നു:
ആൽക്കലൈൻ അന്തരീക്ഷത്തിൽ ആർസെനിക് ആസിഡിൻ്റെ കുറയ്ക്കാനുള്ള സാധ്യത വളരെ കുറവാണ്. അതിനാൽ, ആൽക്കലൈൻ പരിതസ്ഥിതിയിൽ വിപരീത പ്രക്രിയ നടക്കുന്നു:
ഒരു നിഷ്പക്ഷ പരിതസ്ഥിതിയിൽ, രണ്ട് പ്രക്രിയകളെയും ഇനിപ്പറയുന്ന രീതിയിൽ പ്രതിനിധീകരിക്കാം:

എന്നിരുന്നാലും, അവർ അങ്ങനെ ചെയ്യില്ല.
ആദ്യ സമവാക്യം അനുസരിച്ച് പ്രക്രിയ പ്രവർത്തിക്കില്ല, കാരണം ഇത് അയോണുകളുടെ ശേഖരണവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, ഇത് പ്രക്രിയയെ വിപരീത ദിശയിലേക്ക് നയിക്കുന്നു; ഹൈഡ്രോക്സൈഡ് അയോണുകളെ നിർവീര്യമാക്കുന്ന ഒരു അസിഡിക് അന്തരീക്ഷം സൃഷ്ടിക്കപ്പെടുമ്പോൾ മാത്രമേ അത് ഇടത്തുനിന്ന് വലത്തോട്ട് നീങ്ങുകയുള്ളൂ.
രണ്ടാമത്തെ സമവാക്യം അനുസരിച്ച്, പ്രക്രിയ പ്രവർത്തിക്കില്ല, കാരണം ഇത് അയോണുകളുടെ ശേഖരണവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, പ്രതികരണം ഇടത്തുനിന്ന് വലത്തോട്ട് പോകണമെങ്കിൽ ആൽക്കലി ഉപയോഗിച്ച് നിർവീര്യമാക്കണം.
പ്രക്രിയയുടെ ഒപ്റ്റിമൽ ഫ്ലോയ്ക്ക് ആവശ്യമായ പ്രതികരണ അന്തരീക്ഷം സൃഷ്ടിക്കുന്നതിന് ഇനിപ്പറയുന്ന നിയമമുണ്ട്:
ഒരു റെഡോക്സ് പ്രതിപ്രവർത്തനത്തിൻ്റെ ഫലമായി ഹൈഡ്രജൻ അല്ലെങ്കിൽ ഹൈഡ്രോക്സൈഡ് അയോണുകൾ അടിഞ്ഞുകൂടുകയാണെങ്കിൽ, പ്രക്രിയയുടെ ആവശ്യമുള്ള ഗതിക്ക് വിപരീത ഗുണങ്ങളുള്ള ഒരു അന്തരീക്ഷം സൃഷ്ടിക്കേണ്ടത് ആവശ്യമാണ്: അയോണുകളുടെ ശേഖരണത്തിൻ്റെ കാര്യത്തിൽ, പരിസ്ഥിതി ക്ഷാരമായിരിക്കണം, പക്ഷേ അയോണുകളുടെ ശേഖരണത്തിൻ്റെ കാര്യത്തിൽ, പരിസ്ഥിതി അസിഡിറ്റി ആയിരിക്കണം.
പ്രതികരണത്തിനായി, ഒരേ പരിസ്ഥിതി (അസിഡിക് അല്ലെങ്കിൽ ആൽക്കലൈൻ) ആവശ്യമുള്ള ഘടകങ്ങൾ നിങ്ങൾ എടുക്കേണ്ടതുണ്ട്. ഒരു പ്രതിപ്രവർത്തനത്തിൽ ഒരു പദാർത്ഥം ഒരു അസിഡിറ്റി പരിതസ്ഥിതിയിൽ കുറയ്ക്കുന്ന ഏജൻ്റാണെങ്കിൽ, മറ്റൊന്ന് ആൽക്കലൈൻ പരിതസ്ഥിതിയിൽ ഒരു ഓക്സിഡൈസിംഗ് ഏജൻ്റാണെങ്കിൽ, ഈ പ്രക്രിയ തടസ്സപ്പെട്ടേക്കാം; ഈ സാഹചര്യത്തിൽ, ഒരു വലിയ പൊട്ടൻഷ്യൽ വ്യത്യാസത്തിൽ മാത്രമേ പ്രക്രിയ പൂർത്തിയാകൂ, അതായത്, ഉയർന്ന പ്രതികരണ സ്ഥിരതയോടെ.
സന്തുലിത സ്ഥിരാങ്കം ഒരാളെ ഓക്സീകരണത്തിൻ്റെ സാധ്യത പ്രവചിക്കാൻ അനുവദിക്കുന്നു, ഉദാഹരണത്തിന്, നൈട്രിക് ആസിഡ്.
ലെ പിരിച്ചുവിടൽ പ്രതിപ്രവർത്തനത്തിനുള്ള സന്തുലിത സ്ഥിരാങ്കം നമുക്ക് കണ്ടെത്താം. നേർപ്പിച്ചതിൽ നന്നായി ലയിക്കുന്നു. പ്രതികരണത്തിനുള്ള സന്തുലിത സ്ഥിരാങ്കം:
സമവാക്യത്തിൽ നിന്ന് കണക്കാക്കാം:
സ്ഥിരാങ്കത്തിൻ്റെ അത്തരം ഒരു ചെറിയ മൂല്യം സൂചിപ്പിക്കുന്നത്, ഈ പ്രതിപ്രവർത്തനത്തിൻ്റെ സന്തുലിതാവസ്ഥ ഏതാണ്ട് പൂർണ്ണമായും വലത്തുനിന്ന് ഇടത്തേക്ക് മാറ്റപ്പെട്ടിരിക്കുന്നു, അതായത്, മെർക്കുറി സൾഫൈഡ്, കോപ്പർ സൾഫൈഡിന് വിപരീതമായി, നേർപ്പിച്ച ലായനിയിൽ പ്രായോഗികമായി ലയിക്കില്ല.