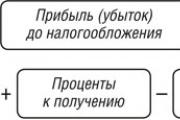
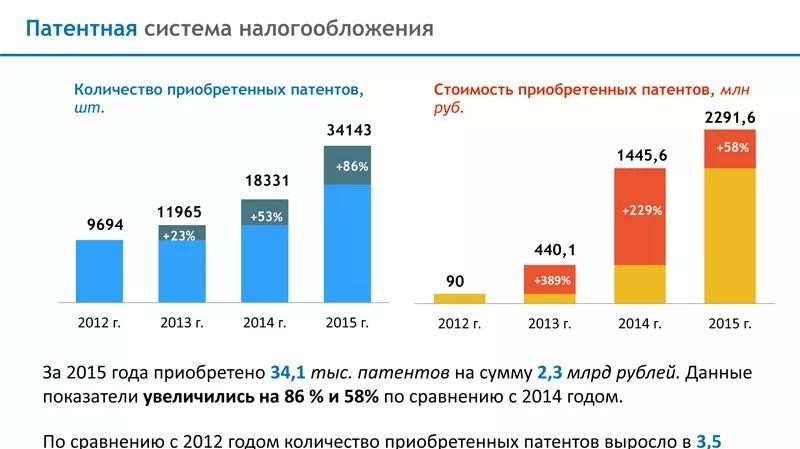
Mennyi meleg. A hőmennyiség. A hőmennyiség mértékegységei. Fajlagos hő. A test felmelegítéséhez szükséges vagy a hűtés során felszabaduló hőmennyiség kiszámítása
« Fizika - 10. osztály"
Milyen folyamatokban mennek végbe az anyag aggregált átalakulásai?
Hogyan változtathatja meg egy anyag aggregációs állapotát?
Bármely test belső energiáját megváltoztathatja munkavégzéssel, fűtéssel vagy éppen ellenkezőleg, hűtéssel.
Tehát a fém kovácsolásakor a munka megtörténik és felmelegszik, ugyanakkor a fém égő lángon hevíthető.
Továbbá, ha a dugattyú rögzített (13.5. ábra), akkor a gáz térfogata nem változik melegítéskor, és nem történik munka. De a gáz hőmérséklete, és így belső energiája is nő.
A belső energia növekedhet és csökkenhet, így hőmennyiség lehet pozitív és negatív is.
Az energia egyik testből a másikba munkavégzés nélkül történő átvitelének folyamatát nevezzük hőcsere.
A belső energia hőátadás során bekövetkező változásának mennyiségi mértékét ún hőmennyiség.
A hőátadás molekuláris képe.
A testek határán történő hőcsere során a hideg test lassan mozgó molekulái és a forró testek gyorsan mozgó molekulái kölcsönhatásba lépnek. Ennek eredményeként a molekulák kinetikai energiái kiegyenlítődnek, és a hideg test molekuláinak sebessége nő, a forró testé pedig csökken.
A hőcsere során az energia nem alakul át egyik formából a másikba, egy felhevültebb test belső energiájának egy része átkerül egy kevésbé fűtött testbe.
Hőmennyiség és hőkapacitás.
Azt már tudod, hogy egy m tömegű test t 1 hőmérsékletről t 2 hőmérsékletre való felmelegítéséhez bizonyos mennyiségű hőt kell átadni neki:
Q = cm(t 2 - t 1) = cm Δt. (13,5)
Amikor egy test lehűl, a végső hőmérséklete t 2 kisebbnek bizonyul, mint a kezdeti hőmérséklet t 1, és a test által leadott hőmennyiség negatív.
A (13.5) képlet c együtthatóját nevezzük fajlagos hőkapacitás anyagokat.
Fajlagos hő- ez a mennyiség számszerűen megegyezik azzal a hőmennyiséggel, amelyet egy 1 kg tömegű anyag kap vagy bocsát ki, ha hőmérséklete 1 K-vel változik.
A gázok fajlagos hőkapacitása a hőátadás folyamatától függ. Ha melegíti a gázt a állandó nyomás, akkor kibővül és működik. Ahhoz, hogy egy gázt állandó nyomáson 1 °C-kal felmelegítsen, több hőt kell átadnia, mint állandó térfogaton, amikor a gáz csak felmelegszik.
A folyadékok és a szilárd anyagok melegítéskor kissé kitágulnak. Fajlagos hőkapacitásuk állandó térfogaton és állandó nyomáson alig különbözik.
Fajlagos párolgási hő.
Ahhoz, hogy egy folyadékot gőzzé alakítsunk a forrás közben, bizonyos mennyiségű hőt kell átadni rá. A folyadék hőmérséklete nem változik, amikor forr. A folyadék gőzzé alakulása állandó hőmérsékleten nem vezet a molekulák kinetikus energiájának növekedéséhez, hanem kölcsönhatásuk potenciális energiájának növekedésével jár. Végül is a gázmolekulák közötti átlagos távolság sokkal nagyobb, mint a folyadékmolekulák között.
Az 1 kg tömegű folyadék állandó hőmérsékletű gőzzé alakításához szükséges hőmennyiséggel számszerűen megegyező mennyiséget ún. fajlagos párolgási hő.
A folyadék elpárolgása bármely hőmérsékleten végbemegy, miközben a leggyorsabb molekulák elhagyják a folyadékot, és a párolgás során lehűl. A párolgási fajhő megegyezik a fajlagos párolgási hővel.
Ezt az értéket r betűvel jelöljük, és joule per kilogrammban (J/kg) fejezzük ki.
Nagyon nagy fajlagos hő vízpárolgás: r H20 = 2,256 10 6 J/kg 100 °C hőmérsékleten. Más folyadékok, például alkohol, éter, higany, kerozin fajlagos párolgási hője 3-10-szer kisebb, mint a vízé.
Az m tömegű folyadék gőzzé alakításához annyi hőre van szükség, mint:
Q p = rm. (13,6)
A gőz lecsapódásakor ugyanannyi hő szabadul fel:
Q k = -rm. (13,7)
Fajlagos olvadási hő.
Amikor egy kristályos test megolvad, a hozzájutott összes hő a molekulák közötti kölcsönhatás potenciális energiájának növelésére megy el. Kinetikus energia A molekulák nem változnak, mivel az olvadás állandó hőmérsékleten megy végbe.
Az olvadásponton 1 kg tömegű kristályos anyag folyadékká alakításához szükséges hőmennyiséggel számszerűen megegyező értéket ún. fajlagos olvadási hőés λ betűvel jelöljük.
Egy 1 kg tömegű anyag kikristályosodásakor pontosan ugyanannyi hő szabadul fel, mint amennyi az olvadáskor elnyelődik.
A jég olvadási fajhője meglehetősen magas: 3,34 10 5 J/kg.
„Ha a jégnek nem lenne nagy olvadási hője, akkor tavasszal a jég teljes tömegének néhány perc vagy másodperc alatt el kellene olvadnia, mivel a levegőből folyamatosan hőátadják a jégnek. Ennek súlyos következményei lennének; elvégre még a jelenlegi helyzetben is nagy árvizek és erős vízhozamok keletkeznek, amikor nagy tömegű jég vagy hó olvad.” R. Fekete, XVIII. század.
Egy m tömegű kristálytest megolvasztásához annyi hőre van szükség, mint:
Qpl = λm. (13,8)
A test kristályosodása során felszabaduló hőmennyiség egyenlő:
Q cr = -λm (13,9)
Az egyenlet hőegyensúly.
Tekintsük a több, kezdetben eltérő hőmérsékletű testből álló rendszer hőcseréjét, például az edényben lévő víz és a vízbe engedett forró vasgolyó közötti hőcserét. Az energiamegmaradás törvénye szerint az egyik test által leadott hőmennyiség számszerűen megegyezik a másik test által leadott hőmennyiséggel.
A leadott hőmennyiség negatívnak, a kapott hőmennyiség pozitívnak minősül. Ezért a Q1 + Q2 teljes hőmennyiség = 0.
Ha egy elszigetelt rendszerben több test között hőcsere történik, akkor
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
A (13.10) egyenletet nevezzük hőmérleg egyenlet.
Itt Q 1 Q 2, Q 3 a testek által kapott vagy leadott hőmennyiség. Ezeket a hőmennyiségeket a (13.5) vagy a (13.6)-(13.9) képletekkel fejezzük ki, ha a hőcsere folyamata során az anyag különböző fázisú átalakulásai (olvadás, kristályosodás, párolgás, kondenzáció) következnek be.
(vagy hőátadás).
Egy anyag fajlagos hőkapacitása.
Hőkapacitás- ez az a hőmennyiség, amelyet egy test 1 fokkal felmelegítve vesz fel.
Egy test hőkapacitását a tőke jelzi latin betű VAL VEL.
Mitől függ egy test hőkapacitása? Először is a tömegétől. Nyilvánvaló, hogy például 1 kilogramm víz felmelegítéséhez több hőre lesz szükség, mint 200 grammra.
Mi a helyzet az anyag típusával? Végezzünk egy kísérletet. Vegyünk két egyforma edényt, és miután az egyikbe 400 g-os vizet, a másikba pedig 400 g-os növényi olajat öntünk, elkezdjük melegíteni őket azonos égőkkel. A hőmérő állásait megfigyelve látni fogjuk, hogy az olaj gyorsan felmelegszik. A víz és az olaj azonos hőmérsékletű felmelegítéséhez a vizet tovább kell melegíteni. De minél tovább melegítjük a vizet, annál több hőt kap az égőtől.
Tehát ugyanazon tömegű különböző anyagok azonos hőmérsékletre való melegítéséhez szükséges különböző mennyiségben melegség. A test felmelegítéséhez szükséges hőmennyiség, és ezáltal a hőkapacitása a testet alkotó anyag típusától függ.
Így például az 1 kg tömegű víz hőmérsékletének 1°C-kal történő növeléséhez 4200 J hőmennyiség szükséges, és ugyanezt a tömeget 1°C-kal kell felmelegíteni. napraforgóolaj a szükséges hőmennyiség 1700 J.
Olyan fizikai mennyiséget nevezünk, amely megmutatja, hogy mennyi hő szükséges 1 kg anyag 1 °C-os felmelegítéséhez fajlagos hőkapacitás ennek az anyagnak.
Minden anyagnak megvan a maga fajlagos hőkapacitása, amelyet a latin c betűvel jelölünk, és joule per kilogramm fokban mérjük (J/(kg °C)).
Fajlagos hő ugyanaz az anyag különböző halmazállapotú (szilárd, folyékony és gáz halmazállapotú) eltérő. Például a víz fajlagos hőkapacitása 4200 J/(kg °C), a jég fajlagos hőkapacitása 2100 J/(kg °C); Az alumínium szilárd állapotban 920 J/(kg - °C), folyékony állapotban pedig 1080 J/(kg - °C) fajlagos hőkapacitású.
Vegye figyelembe, hogy a víz nagyon nagy fajlagos hőkapacitású. Ezért a tengerekben és óceánokban nyáron felmelegedő víz felszívódik a levegőből nagyszámú hőség. Ennek köszönhetően azokon a helyeken, amelyek nagy víztestek közelében helyezkednek el, a nyár nem olyan meleg, mint a víztől távol eső helyeken.
A test felmelegítéséhez szükséges vagy a hűtés során felszabaduló hőmennyiség kiszámítása.
A fentiekből kitűnik, hogy a test felmelegítéséhez szükséges hőmennyiség függ attól, hogy a test milyen anyagból áll (azaz fajlagos hőkapacitásától), valamint a test tömegétől. Az is világos, hogy a hőmennyiség attól függ, hogy hány fokkal emeljük a testhőmérsékletet.
Tehát a test felmelegítéséhez szükséges vagy a hűtés során felszabaduló hőmennyiség meghatározásához meg kell szorozni a test fajlagos hőkapacitását a tömegével, valamint a végső és a kezdeti hőmérséklet különbségével:
K = cm (t 2 - t 1 ) ,
Ahol K- hőmennyiség, c— fajlagos hőkapacitás, m- testtömeg, t 1 - kezdeti hőmérséklet, t 2 - végső hőmérséklet.
Amikor a test felmelegszik t 2 > t 1 és ezért K > 0 . Amikor a test lehűl t 2i< t 1 és ezért K< 0 .
Ha ismert az egész test hőkapacitása VAL VEL, K képlet határozza meg:
Q = C (t 2 - t 1 ) .
Mi melegszik fel gyorsabban a tűzhelyen - egy vízforraló vagy egy vödör víz? A válasz nyilvánvaló - egy teáskanna. Akkor a második kérdés az, hogy miért?
A válasz nem kevésbé nyilvánvaló - mert a vízforralóban kisebb a víz tömege. Nagy. És most magad is meg tudod csinálni az igazit fizikai tapasztalat otthon. Ehhez két egyforma kis serpenyőre, azonos mennyiségű vízre és növényi olaj, például fél liter és egy tűzhely. Helyezze az edényeket olajjal és vízzel ugyanarra a hőre. Most figyeld, mi fog gyorsabban felmelegedni. Ha van folyadékhőmérőd, használhatod, ha nincs, akkor egyszerűen ellenőrizheted időnként az ujjaddal a hőmérsékletet, csak vigyázz, nehogy megégjen. Mindenesetre hamarosan látni fogja, hogy az olaj jelentősen felmelegszik gyorsabb, mint a víz. És még egy kérdés, ami tapasztalat formájában is megvalósítható. Melyik fog gyorsabban felforrni - meleg víz vagy hideg? Ismét minden nyilvánvaló – a meleg lesz az első a célegyenesben. Miért ezek a furcsa kérdések és kísérletek? Hogy meghatározza fizikai mennyiség, az úgynevezett „hőmennyiség”.
A hőmennyiség
A hőmennyiség az az energia, amelyet a test a hőátadás során veszít vagy nyer. Ez egyértelmű a névből. Hűtéskor a szervezet bizonyos mennyiségű hőt veszít, melegítéskor pedig felveszi. A kérdéseinkre adott válaszok pedig megmutatták nekünk Mitől függ a hőmennyiség? Először is, minél többet testtömeg, annál több hőt kell költeni ahhoz, hogy a hőmérséklete egy fokkal megváltozzon. Másodszor, a test felmelegítéséhez szükséges hőmennyiség attól függ, hogy milyen anyagból áll, vagyis az anyag típusától. Harmadszor pedig a testhőmérséklet hőátadás előtti és utáni különbsége is fontos számításainkhoz. A fentiek alapján megtehetjük határozza meg a hőmennyiséget a képlet segítségével:
Q=cm(t_2-t_1) ,
ahol Q a hőmennyiség,
m - testtömeg,
(t_2-t_1) - a kezdeti és a végső testhőmérséklet közötti különbség,
c az anyag fajlagos hőkapacitása a megfelelő táblázatokból.
Ezzel a képlettel kiszámíthatja azt a hőmennyiséget, amely bármely test felmelegítéséhez szükséges, vagy amelyet ez a test hűtéskor felszabadít.
A hőmennyiséget joule-ban (1 J) mérik, mint minden energiafajtát. Ezt az értéket azonban nem olyan régen vezették be, és az emberek sokkal korábban kezdték el mérni a hőmennyiséget. És egy korunkban széles körben használt egységet használtak - kalória (1 cal). 1 kalória az a hőmennyiség, amely 1 gramm víz 1 Celsius-fokkal való felmelegítéséhez szükséges. Ezektől az adatoktól vezérelve azok, akik szeretik az elfogyasztott ételek kalóriáit számolni, szórakozásból kiszámolhatják, hogy a nap folyamán étellel elfogyasztott energiából hány liter vizet lehet felforralni.
Mi melegszik fel gyorsabban a tűzhelyen - egy vízforraló vagy egy vödör víz? A válasz nyilvánvaló - egy teáskanna. Akkor a második kérdés az, hogy miért?
A válasz nem kevésbé nyilvánvaló - mert a vízforralóban kisebb a víz tömege. Nagy. Most pedig igazi fizikai élményt szerezhet otthon. Ehhez két egyforma kis serpenyőre, azonos mennyiségű vízre és növényi olajra, például fél literre és egy tűzhelyre lesz szüksége. Helyezze az edényeket olajjal és vízzel ugyanarra a hőre. Most figyeld, mi fog gyorsabban felmelegedni. Ha van folyadékhőmérőd, használhatod, ha nincs, akkor egyszerűen ellenőrizheted időnként az ujjaddal a hőmérsékletet, csak vigyázz, nehogy megégjen. Mindenesetre hamarosan látni fogja, hogy az olaj sokkal gyorsabban melegszik fel, mint a víz. És még egy kérdés, ami tapasztalat formájában is megvalósítható. Mi fog gyorsabban felforrni - meleg víz vagy hideg? Ismét minden nyilvánvaló – a meleg lesz az első a célegyenesben. Miért ezek a furcsa kérdések és kísérletek? A „hőmennyiségnek” nevezett fizikai mennyiség meghatározása.
A hőmennyiség
A hőmennyiség az az energia, amelyet a test a hőátadás során veszít vagy nyer. Ez egyértelmű a névből. Hűtéskor a szervezet bizonyos mennyiségű hőt veszít, melegítéskor pedig felveszi. A kérdéseinkre adott válaszok pedig megmutatták nekünk Mitől függ a hőmennyiség? Először is, minél nagyobb egy test tömege, annál nagyobb hőmennyiséget kell felhasználni a hőmérséklet egy fokkal történő megváltoztatásához. Másodszor, a test felmelegítéséhez szükséges hőmennyiség attól függ, hogy milyen anyagból áll, vagyis az anyag típusától. Harmadszor pedig a testhőmérséklet hőátadás előtti és utáni különbsége is fontos számításainkhoz. A fentiek alapján megtehetjük határozza meg a hőmennyiséget a képlet segítségével:
ahol Q a hőmennyiség,
m - testtömeg,
(t_2-t_1) - a kezdeti és a végső testhőmérséklet közötti különbség,
c az anyag fajlagos hőkapacitása a megfelelő táblázatokból.
Ezzel a képlettel kiszámíthatja azt a hőmennyiséget, amely bármely test felmelegítéséhez szükséges, vagy amelyet ez a test hűtéskor felszabadít.
A hőmennyiséget joule-ban (1 J) mérik, mint minden energiafajtát. Ezt az értéket azonban nem olyan régen vezették be, és az emberek sokkal korábban kezdték el mérni a hőmennyiséget. És egy korunkban széles körben használt egységet használtak - kalória (1 cal). 1 kalória az a hőmennyiség, amely 1 gramm víz 1 Celsius-fokkal való felmelegítéséhez szükséges. Ezektől az adatoktól vezérelve azok, akik szeretik az elfogyasztott ételek kalóriáit számolni, szórakozásból kiszámolhatják, hogy a nap folyamán étellel elfogyasztott energiából hány liter vizet lehet felforralni.
A termodinamikai rendszer belső energiája kétféleképpen változtatható:
- végezni rendszer munka,
- termikus kölcsönhatás felhasználásával.
A testnek való hőátadás nem kapcsolódik a testen végzett makroszkopikus munkavégzéshez. BAN BEN ebben az esetben A belső energia változását az okozza, hogy a magasabb hőmérsékletű test egyes molekulái az alacsonyabb hőmérsékletű test egyes molekuláin dolgoznak. Ebben az esetben a termikus kölcsönhatás a hővezető képesség miatt valósul meg. Az energiaátvitel sugárzással is lehetséges. A mikroszkopikus folyamatok rendszerét (amely nem az egész testre, hanem az egyes molekulákra vonatkozik) hőátadásnak nevezzük. A hőátadás eredményeként egyik testből a másikba átvitt energia mennyiségét az egyik testről a másikra átvitt hőmennyiség határozza meg.
Meghatározás
Melegség az az energia, amelyet egy test a környező testekkel (környezettel) történő hőcsere során kap (vagy lead). A hő szimbóluma általában a Q betű.
Ez a termodinamika egyik alapmennyisége. A hő szerepel a termodinamika első és második törvényének matematikai kifejezéseiben. A hőről azt mondják, hogy energia molekulamozgás formájában.
A hőt át lehet adni a rendszernek (testnek), vagy el lehet venni onnan. Úgy gondolják, hogy ha hőt adnak át a rendszernek, akkor az pozitív.
Képlet a hő kiszámításához, amikor a hőmérséklet változik
Az elemi hőmennyiséget jelöljük. Vegyük észre, hogy az a hőelem, amelyet a rendszer kis állapotváltozással kap (ad), nem teljes differenciál. Ennek az az oka, hogy a hő a rendszer állapotváltozási folyamatának függvénye.
A rendszerre átadott elemi hőmennyiség, és a hőmérséklet T-ről T+dT-re változik, egyenlő:
ahol C a test hőkapacitása. Ha a kérdéses test homogén, akkor a hőmennyiség (1) képlete a következőképpen ábrázolható:
ahol a test fajlagos hőkapacitása, m a test tömege, a moláris hőkapacitása, – moláris tömeg anyag, az anyag móljainak száma.
Ha a test homogén, és a hőkapacitást a hőmérséklettől függetlennek tekintjük, akkor az a hőmennyiség (), amelyet a test kap, amikor a hőmérséklete bizonyos mértékben emelkedik, a következőképpen számítható ki:
ahol t 2, t 1 testhőmérséklet melegítés előtt és után. Kérjük, vegye figyelembe, hogy a különbség () kiszámításakor a hőmérsékletek Celsius-fokban és kelvinben egyaránt helyettesíthetők.
A fázisátalakulások során fellépő hőmennyiség képlete
Az anyag egyik fázisából a másikba való átmenet egy bizonyos mennyiségű hő elnyelésével vagy felszabadulásával jár, amit fázisátalakulás hőjének nevezünk.
Tehát ahhoz, hogy egy anyagelemet szilárd halmazállapotból folyadékba vigyünk át, a hőmennyiséget () meg kell adni:
![]()
ahol a fajlagos olvadási hő, dm a testtömeg eleme. Figyelembe kell venni, hogy a test hőmérsékletének meg kell egyeznie a kérdéses anyag olvadáspontjával. A kristályosodás során a (4)-nek megfelelő hő szabadul fel.
A folyadék gőzzé alakításához szükséges hőmennyiség (párolgáshő) a következőképpen határozható meg:
![]()
ahol r a fajlagos párolgási hő. Amikor a gőz lecsapódik, hő szabadul fel. A párolgáshő egyenlő az azonos tömegű anyagok kondenzációs hőjével.
Egységek a hőmennyiség mérésére
Az SI rendszerben a hőmennyiség alapvető mértékegysége: [Q]=J
Rendszeren kívüli hőegység, amely gyakran megtalálható a műszaki számításokban. [Q] = kalória (kalória). 1 cal = 4,1868 J.
Példák problémamegoldásra
Példa
Gyakorlat. Mekkora térfogatú vizet kell összekeverni, hogy 200 liter vizet kapjunk t = 40 C hőmérsékleten, ha egy tömeg víz hőmérséklete t 1 = 10 C, a második tömegé t 2 = 60 C ?
Megoldás.Írjuk fel a hőmérleg egyenletét a következő formában:
ahol Q=cmt a víz összekeverése után előállított hőmennyiség; Q 1 = cm 1 t 1 - a t 1 hőmérsékletű és m 1 tömegű víz egy részének hőmennyisége; Q 2 = cm 2 t 2 - a t 2 hőmérsékletű és m 2 tömegű víz egy részének hőmennyisége.
Az (1.1) egyenletből a következő:
Ha a hideg (V 1) és a forró (V 2) vízrészeket egyetlen térfogatban (V) egyesítjük, feltételezhetjük, hogy:
Tehát egy egyenletrendszert kapunk:
![]()
A megoldást követően a következőket kapjuk:
![]()