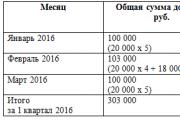
ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടന. ഒരു ആറ്റത്തിൻ്റെ ഘടനയുടെ ഡയഗ്രം: ന്യൂക്ലിയസ്, ഇലക്ട്രോൺ ഷെൽ. ഉദാഹരണങ്ങൾ
ഏത് പദാർത്ഥവും നിർമ്മിച്ചിരിക്കുന്നത് വളരെ ചെറിയ കണികകൾ കൊണ്ടാണ് ആറ്റങ്ങൾ . ഏറ്റവും ചെറിയ കണികയാണ് ആറ്റം രാസ മൂലകം, അതിൻ്റെ എല്ലാ സ്വഭാവ സവിശേഷതകളും സംരക്ഷിക്കുന്നു. ഒരു ആറ്റത്തിൻ്റെ വലുപ്പം സങ്കൽപ്പിക്കാൻ, അവയെ പരസ്പരം അടുത്ത് സ്ഥാപിക്കാൻ കഴിയുമെങ്കിൽ, ഒരു ദശലക്ഷം ആറ്റങ്ങൾ 0.1 മില്ലിമീറ്റർ മാത്രം ദൂരം ഉൾക്കൊള്ളുമെന്ന് പറഞ്ഞാൽ മതി.
ദ്രവ്യത്തിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള ശാസ്ത്രത്തിൻ്റെ കൂടുതൽ വികസനം, ആറ്റത്തിനും ഒരു സങ്കീർണ്ണ ഘടനയുണ്ടെന്നും ഇലക്ട്രോണുകളും പ്രോട്ടോണുകളും അടങ്ങിയിരിക്കുന്നുവെന്നും കാണിച്ചു. അങ്ങനെയാണ് ദ്രവ്യത്തിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള ഇലക്ട്രോണിക് സിദ്ധാന്തം ഉടലെടുത്തത്.
പുരാതന കാലത്ത് രണ്ട് തരം വൈദ്യുതി ഉണ്ടെന്ന് കണ്ടെത്തി: പോസിറ്റീവ്, നെഗറ്റീവ്. ശരീരത്തിൽ അടങ്ങിയിരിക്കുന്ന വൈദ്യുതിയുടെ അളവ് ചാർജ് എന്ന് വിളിക്കപ്പെട്ടു. ഒരു ശരീരത്തിൻ്റെ കൈവശമുള്ള വൈദ്യുതിയുടെ തരം അനുസരിച്ച്, ചാർജ് പോസിറ്റീവ് അല്ലെങ്കിൽ നെഗറ്റീവ് ആകാം.
ചാർജുകൾ പോലെയുള്ള ചാർജുകൾ പുറന്തള്ളുന്നതും ചാർജുകളിൽ നിന്ന് വ്യത്യസ്തമായി ആകർഷിക്കുന്നതും പരീക്ഷണാത്മകമായി സ്ഥാപിക്കപ്പെട്ടു.
നമുക്ക് പരിഗണിക്കാം ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടന. ആറ്റങ്ങൾ തങ്ങളെക്കാൾ ചെറിയ കണങ്ങൾ കൊണ്ടാണ് നിർമ്മിച്ചിരിക്കുന്നത് ഇലക്ട്രോണുകൾ.
നിർവ്വചനം:ഏറ്റവും ചെറിയ നെഗറ്റീവ് വൈദ്യുത ചാർജ് ഉള്ള ദ്രവ്യത്തിൻ്റെ ഏറ്റവും ചെറിയ കണികയാണ് ഇലക്ട്രോൺ.
ഒന്നോ അതിലധികമോ അടങ്ങുന്ന ഒരു കേന്ദ്ര ന്യൂക്ലിയസിന് ചുറ്റും ഇലക്ട്രോണുകൾ പരിക്രമണം ചെയ്യുന്നു പ്രോട്ടോണുകൾഒപ്പം ന്യൂട്രോണുകൾ, കേന്ദ്രീകൃത ഭ്രമണപഥങ്ങളിൽ. ഇലക്ട്രോണുകൾ നെഗറ്റീവ് ചാർജുള്ള കണങ്ങളാണ്, പ്രോട്ടോണുകൾ പോസിറ്റീവ് ചാർജുള്ളവയാണ്, ന്യൂട്രോണുകൾ ന്യൂട്രൽ ആണ് (ചിത്രം 1.1).
നിർവ്വചനം:ഏറ്റവും ചെറിയ പോസിറ്റീവ് ഇലക്ട്രിക്കൽ ചാർജ് ഉള്ള ദ്രവ്യത്തിൻ്റെ ഏറ്റവും ചെറിയ കണികയാണ് പ്രോട്ടോൺ.
ഇലക്ട്രോണുകളുടെയും പ്രോട്ടോണുകളുടെയും അസ്തിത്വം സംശയാതീതമാണ്. ശാസ്ത്രജ്ഞർ ഇലക്ട്രോണുകളുടെയും പ്രോട്ടോണുകളുടെയും പിണ്ഡം, ചാർജ്, വലുപ്പം എന്നിവ നിർണ്ണയിക്കുക മാത്രമല്ല, വിവിധ ഇലക്ട്രിക്കൽ, റേഡിയോ എഞ്ചിനീയറിംഗ് ഉപകരണങ്ങളിൽ പ്രവർത്തിക്കുകയും ചെയ്തു.
ഇലക്ട്രോണിൻ്റെ പിണ്ഡം അതിൻ്റെ ചലനത്തിൻ്റെ വേഗതയെ ആശ്രയിച്ചിരിക്കുന്നുവെന്നും ഇലക്ട്രോൺ ബഹിരാകാശത്ത് മുന്നോട്ട് നീങ്ങുക മാത്രമല്ല, അതിൻ്റെ അച്ചുതണ്ടിന് ചുറ്റും കറങ്ങുകയും ചെയ്യുന്നുവെന്നും കണ്ടെത്തി.
ഘടനയിൽ ഏറ്റവും ലളിതമായത് ഹൈഡ്രജൻ ആറ്റമാണ് (ചിത്രം 1.1). അതിൽ ഒരു പ്രോട്ടോൺ ന്യൂക്ലിയസും ന്യൂക്ലിയസിന് ചുറ്റും വലിയ വേഗതയിൽ കറങ്ങുന്ന ഒരു ഇലക്ട്രോണും അടങ്ങിയിരിക്കുന്നു, ഇത് ആറ്റത്തിൻ്റെ പുറം ഷെൽ (ഭ്രമണപഥം) ഉണ്ടാക്കുന്നു. കൂടുതൽ സങ്കീർണ്ണമായ ആറ്റങ്ങൾക്ക് ഇലക്ട്രോണുകൾ കറങ്ങുന്ന നിരവധി ഷെല്ലുകൾ ഉണ്ട്.
ഈ ഷെല്ലുകൾ ന്യൂക്ലിയസിൽ നിന്ന് തുടർച്ചയായി ഇലക്ട്രോണുകൾ കൊണ്ട് നിറഞ്ഞിരിക്കുന്നു (ചിത്രം 1.2).

ഇനി നമുക്ക് അത് നോക്കാം . ഏറ്റവും പുറത്തുള്ള ഷെൽ എന്ന് വിളിക്കുന്നു വാലൻസി, അതിൽ അടങ്ങിയിരിക്കുന്ന ഇലക്ട്രോണുകളുടെ എണ്ണത്തെ വിളിക്കുന്നു വാലൻസി. കാമ്പിൽ നിന്ന് അകലെ വാലൻസ് ഷെൽ,അതിനാൽ, ന്യൂക്ലിയസിൽ നിന്ന് ഓരോ വാലൻസ് ഇലക്ട്രോണും അനുഭവപ്പെടുന്ന ആകർഷണബലം കുറവാണ്. അങ്ങനെ, വാലൻസ് ഷെൽ നിറയ്ക്കാത്തതും ന്യൂക്ലിയസിൽ നിന്ന് വളരെ അകലെ സ്ഥിതി ചെയ്യുന്നതും അല്ലെങ്കിൽ അവ നഷ്ടപ്പെടുന്നതുമായ സാഹചര്യത്തിൽ ഇലക്ട്രോണുകൾ സ്വയം ഘടിപ്പിക്കാനുള്ള കഴിവ് ആറ്റം വർദ്ധിപ്പിക്കുന്നു.
പുറം ഷെൽ ഇലക്ട്രോണുകൾക്ക് ഊർജ്ജം ലഭിക്കും. വാലൻസ് ഷെല്ലിലെ ഇലക്ട്രോണുകൾ സ്വീകരിക്കുകയാണെങ്കിൽ ആവശ്യമായ ലെവൽനിന്ന് ഊർജ്ജം ബാഹ്യശക്തികൾ, അവർക്ക് അതിൽ നിന്ന് വേർപെടുത്താനും ആറ്റം വിടാനും കഴിയും, അതായത് സ്വതന്ത്ര ഇലക്ട്രോണുകൾ. സ്വതന്ത്ര ഇലക്ട്രോണുകൾക്ക് ഒരു ആറ്റത്തിൽ നിന്ന് ആറ്റത്തിലേക്ക് ക്രമരഹിതമായി നീങ്ങാൻ കഴിയും. ധാരാളം സ്വതന്ത്ര ഇലക്ട്രോണുകൾ അടങ്ങിയിരിക്കുന്ന പദാർത്ഥങ്ങളെ വിളിക്കുന്നു കണ്ടക്ടർമാർ
.
ഇൻസുലേറ്ററുകൾ
, കണ്ടക്ടർമാരുടെ വിപരീതമാണ്. അവ ചോർച്ച തടയുന്നു വൈദ്യുത പ്രവാഹം. ഇൻസുലേറ്ററുകൾ സ്ഥിരതയുള്ളതാണ്, കാരണം ചില ആറ്റങ്ങളുടെ വാലൻസ് ഇലക്ട്രോണുകൾ മറ്റ് ആറ്റങ്ങളുടെ വാലൻസ് ഷെല്ലുകൾ നിറയ്ക്കുകയും അവയുമായി ചേരുകയും ചെയ്യുന്നു. ഇത് സ്വതന്ത്ര ഇലക്ട്രോണുകളുടെ രൂപീകരണം തടയുന്നു.
ഇൻസുലേറ്ററുകൾക്കും കണ്ടക്ടർമാർക്കും ഇടയിൽ ഒരു ഇൻ്റർമീഡിയറ്റ് സ്ഥാനം പിടിക്കുക അർദ്ധചാലകങ്ങൾ
, എന്നാൽ ഞങ്ങൾ അവരെ കുറിച്ച് പിന്നീട് സംസാരിക്കും
നമുക്ക് പരിഗണിക്കാം ആറ്റത്തിൻ്റെ ഗുണവിശേഷതകൾ. ഒരേ എണ്ണം ഇലക്ട്രോണുകളും പ്രോട്ടോണുകളും ഉള്ള ഒരു ആറ്റം വൈദ്യുതപരമായി ന്യൂട്രൽ ആണ്. ഒന്നോ അതിലധികമോ ഇലക്ട്രോണുകൾ നേടുന്ന ഒരു ആറ്റം നെഗറ്റീവ് ചാർജ്ജ് ആകുകയും അതിനെ നെഗറ്റീവ് അയോൺ എന്ന് വിളിക്കുകയും ചെയ്യുന്നു. ഒരു ആറ്റത്തിന് ഒന്നോ അതിലധികമോ ഇലക്ട്രോണുകൾ നഷ്ടപ്പെട്ടാൽ, അത് പോസിറ്റീവ് അയോണായി മാറുന്നു, അതായത്, അത് പോസിറ്റീവ് ചാർജായി മാറുന്നു.
മെൻഡലീവിൻ്റെ മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടിക. ആറ്റത്തിൻ്റെ ഘടന.
മെൻഡലീവിൻ്റെ പീരിയോഡിക് സിസ്റ്റം ഓഫ് എലമെൻ്റുകൾ - രാസ വർഗ്ഗീകരണം. റഷ്യൻ സൃഷ്ടിച്ച ഘടകങ്ങൾ. മെൻഡലീവ് (1869-ൽ) കണ്ടെത്തിയ ആവർത്തനത്തിൻ്റെ അടിസ്ഥാനത്തിൽ ശാസ്ത്രജ്ഞൻ ഡി.ഐ. നിയമം.
ആധുനികം ആനുകാലിക രൂപീകരണം നിയമം: മൂലകങ്ങളുടെ ഗുണങ്ങൾ (ലളിതമായ സംയുക്തങ്ങളിലും സംയുക്തങ്ങളിലും പ്രകടമാണ്) ആനുകാലിക കാലഘട്ടങ്ങളിൽ കാണപ്പെടുന്നു. അവയുടെ ആറ്റങ്ങളുടെ ന്യൂക്ലിയസുകളുടെ ചാർജിനെ ആശ്രയിച്ച്.
ചാർജ് ചെയ്യുക ആറ്റോമിക് ന്യൂക്ലിയസ് Z രാസവസ്തുവിൻ്റെ ആറ്റോമിക (ഓർഡിനൽ) സംഖ്യയ്ക്ക് തുല്യമാണ്. പി.എസിലെ ഘടകം. ഇ. M. നിങ്ങൾ എല്ലാ ഘടകങ്ങളും ആരോഹണ ക്രമത്തിൽ ക്രമീകരിച്ചാൽ Z. (ഹൈഡ്രജൻ H, Z = 1; ഹീലിയം He, Z = 2; ലിഥിയം Li, Z == 3; ബെറിലിയം Be, Z = 4, മുതലായവ), അവ രൂപം കൊള്ളുന്നു 7 കാലഘട്ടങ്ങൾ. ഈ ഓരോ കാലഘട്ടത്തിലും, മൂലകങ്ങളുടെ ഗുണങ്ങളിൽ ക്രമമായ മാറ്റം നിരീക്ഷിക്കപ്പെടുന്നു, കാലഘട്ടത്തിലെ ആദ്യ മൂലകം (ആൽക്കലി ലോഹം) മുതൽ അവസാനത്തേത് (ഉയർന്ന വാതകം). ആദ്യ കാലഘട്ടത്തിൽ 2 ഘടകങ്ങൾ അടങ്ങിയിരിക്കുന്നു, 2-ഉം 3-ഉം - 8 ഘടകങ്ങൾ വീതം, 4-ഉം 5-ഉം - 18, 6-ആം - 32. 7-ആം കാലഘട്ടത്തിൽ, 19 ഘടകങ്ങൾ അറിയപ്പെടുന്നു. 2-ഉം 3-ഉം പിരീഡുകളെ സാധാരണയായി ചെറുത് എന്ന് വിളിക്കുന്നു, തുടർന്നുള്ള എല്ലാ കാലഘട്ടങ്ങളെയും വലുത് എന്ന് വിളിക്കുന്നു. നിങ്ങൾ തിരശ്ചീന വരികളുടെ രൂപത്തിൽ കാലഘട്ടങ്ങൾ ക്രമീകരിക്കുകയാണെങ്കിൽ, ഫലം പട്ടിക 8 ലംബ വരകൾ കാണിക്കും. നിരകൾ; ഇവ അവയുടെ ഗുണങ്ങളിൽ സമാനമായ മൂലകങ്ങളുടെ ഗ്രൂപ്പുകളാണ്.
Z ൻ്റെ വർദ്ധനവിനെ ആശ്രയിച്ച് ഗ്രൂപ്പുകൾക്കുള്ളിലെ മൂലകങ്ങളുടെ ഗുണങ്ങളും സ്വാഭാവികമായും മാറുന്നു. ഉദാഹരണത്തിന്, Li - Na - K - Rb - Cs - Fr ഗ്രൂപ്പിൽ, രാസ ഉള്ളടക്കം വർദ്ധിക്കുന്നു. ലോഹത്തിൻ്റെ പ്രവർത്തനം മെച്ചപ്പെടുത്തുന്നു ഓക്സൈഡുകളുടെയും ഹൈഡ്രോക്സൈഡുകളുടെയും സ്വഭാവം.
ആറ്റോമിക് ഘടനയുടെ സിദ്ധാന്തത്തിൽ നിന്ന്, മൂലകങ്ങളുടെ ഗുണങ്ങളുടെ ആനുകാലികത നിർണ്ണയിക്കുന്നത് ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള ഇലക്ട്രോൺ ഷെല്ലുകളുടെ രൂപീകരണ നിയമങ്ങളാൽ നിർണ്ണയിക്കപ്പെടുന്നു. മൂലകത്തിൻ്റെ Z വർദ്ധിക്കുന്നതിനനുസരിച്ച്, ആറ്റം കൂടുതൽ സങ്കീർണ്ണമാകുന്നു - ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള ഇലക്ട്രോണുകളുടെ എണ്ണം വർദ്ധിക്കുന്നു, ഒരു ഇലക്ട്രോൺ ഷെല്ലിൻ്റെ പൂരിപ്പ് അവസാനിക്കുകയും അടുത്ത, പുറം ഷെല്ലിൻ്റെ രൂപീകരണം ആരംഭിക്കുകയും ചെയ്യുമ്പോൾ ഒരു നിമിഷം വരുന്നു. മെൻഡലീവ് സമ്പ്രദായത്തിൽ, ഇത് ഒരു പുതിയ കാലഘട്ടത്തിൻ്റെ തുടക്കവുമായി പൊരുത്തപ്പെടുന്നു. ഒരു പുതിയ ഷെല്ലിലെ 1, 2, 3, മുതലായവ ഇലക്ട്രോണുകളുള്ള മൂലകങ്ങൾ അവയുടെ ഗുണങ്ങളിൽ 1, 2, 3, മുതലായ ബാഹ്യ ഇലക്ട്രോണുകൾ ഉള്ള മൂലകങ്ങൾക്ക് സമാനമാണ്, അവയുടെ സംഖ്യ ആന്തരികമാണെങ്കിലും. ഒന്നോ അതിലധികമോ ഇലക്ട്രോൺ ഷെല്ലുകൾ കുറവായിരുന്നു: Na എന്നത് Li (ഒരു ബാഹ്യ ഇലക്ട്രോൺ), Mg എന്നത് Be പോലെയാണ് (2 ബാഹ്യ ഇലക്ട്രോണുകൾ); A1 - മുതൽ B വരെ (3 ബാഹ്യ ഇലക്ട്രോണുകൾ), മുതലായവ. P. കളിലെ മൂലകത്തിൻ്റെ സ്ഥാനം കൊണ്ട്. ഇ. എം. അതിൻ്റെ രാസവസ്തുക്കളുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു. കൂടാതെ പലതും ശാരീരികമായ സെൻ്റ്.
നിരവധി (ഏകദേശം 1000) ഗ്രാഫിക് ഓപ്ഷനുകൾ നിർദ്ദേശിച്ചിട്ടുണ്ട്. P. യുടെ ചിത്രങ്ങൾ ഇ. M. P. കളുടെ ഏറ്റവും സാധാരണമായ 2 വകഭേദങ്ങൾ. ഇ. എം. - ചെറുതും നീണ്ടതുമായ പട്ടികകൾ; കെ.-എൽ. അടിസ്ഥാനപരമായ വ്യത്യാസംഅവർക്കിടയിൽ ഒന്നുമില്ല. അനുബന്ധത്തിൽ ഹ്രസ്വ പട്ടിക ഓപ്ഷനുകളിലൊന്ന് അടങ്ങിയിരിക്കുന്നു. പട്ടികയിൽ, ആദ്യ നിരയിൽ പീരിയഡ് നമ്പറുകൾ നൽകിയിരിക്കുന്നു (സൂചിപ്പിച്ചിരിക്കുന്നു അറബി അക്കങ്ങൾ 1 - 7). ഗ്രൂപ്പ് നമ്പറുകൾ റോമൻ അക്കങ്ങൾ I - VIII ഉപയോഗിച്ച് മുകളിൽ സൂചിപ്പിച്ചിരിക്കുന്നു. ഓരോ ഗ്രൂപ്പിനെയും രണ്ട് ഉപഗ്രൂപ്പുകളായി തിരിച്ചിരിക്കുന്നു - എ, ബി. ചെറിയ കാലഘട്ടങ്ങളിലെ മൂലകങ്ങൾ നയിക്കുന്ന മൂലകങ്ങളുടെ ഒരു കൂട്ടം, ചിലപ്പോൾ വിളിക്കുന്നു. പ്രധാന ഉപഗ്രൂപ്പുകൾ a-m ഉം (Li ഉപഗ്രൂപ്പിൻ്റെ തലവനും ആണ് ക്ഷാര ലോഹങ്ങൾ. എഫ് - ഹാലൊജനുകൾ, അവൻ - നിഷ്ക്രിയ വാതകങ്ങൾ മുതലായവ). ഈ സാഹചര്യത്തിൽ, വലിയ കാലഘട്ടങ്ങളിലെ മൂലകങ്ങളുടെ ശേഷിക്കുന്ന ഉപഗ്രൂപ്പുകളെ വിളിക്കുന്നു. പാർശ്വ ഫലങ്ങൾ.
Z = 58 - 71 ഉള്ള മൂലകങ്ങൾ അവയുടെ ആറ്റങ്ങളുടെ ഘടനയുടെ പ്രത്യേക അടുപ്പവും അവയുടെ രസതന്ത്രത്തിൻ്റെ സമാനതയും കാരണം. ഗ്രൂപ്പ് III-ൽ ഉൾപ്പെടുത്തിയിട്ടുള്ള ലാന്തനൈഡ് കുടുംബത്തെ സെൻ്റ് നിർമ്മിക്കുന്നു, എന്നാൽ സൗകര്യാർത്ഥം മേശയുടെ അടിയിൽ സ്ഥാപിച്ചിരിക്കുന്നു. Z = 90 - 103 ഉള്ള മൂലകങ്ങൾ പലപ്പോഴും ഇതേ കാരണങ്ങളാൽ ആക്ടിനൈഡ് കുടുംബമായി വർഗ്ഗീകരിക്കപ്പെടുന്നു. Z = 104 - curchatovy ഉള്ള ഒരു മൂലകവും Z = 105 ഉള്ള ഒരു മൂലകവും അവരെ പിന്തുടരുന്നു (Nilsborium കാണുക). 1974 ജൂലൈയിൽ മൂങ്ങകൾ. ഭൗതികശാസ്ത്രജ്ഞർ Z = 106 ഉള്ള ഒരു മൂലകം കണ്ടെത്തിയതായി ജനുവരിയിൽ റിപ്പോർട്ട് ചെയ്തു. 1976 - Z = 107 ഉള്ള മൂലകങ്ങൾ. പിന്നീട് Z = 108 ഉം 109 ഉം ഉള്ള മൂലകങ്ങൾ സമന്വയിപ്പിച്ചു. P. യുടെ അതിർത്തി ഇ. M. അറിയപ്പെടുന്നു - ഇത് ഹൈഡ്രജനാണ് നൽകുന്നത്, കാരണം ഒന്നിൽ താഴെ ന്യൂക്ലിയർ ചാർജ് ഉള്ള ഒരു മൂലകം ഉണ്ടാകില്ല. P. യുടെ ഉയർന്ന പരിധി എന്താണ് എന്നതാണ് ചോദ്യം. ഇ. എം., അതായത് കലയ്ക്ക് എന്ത് തീവ്രമായ മൂല്യത്തിലേക്ക് എത്താൻ കഴിയും. മൂലകങ്ങളുടെ സമന്വയം പരിഹരിക്കപ്പെടാതെ തുടരുന്നു. (കനത്ത അണുകേന്ദ്രങ്ങൾ അസ്ഥിരമാണ്, അതിനാൽ Z = 95 ഉള്ള അമേരിസിയവും തുടർന്നുള്ള മൂലകങ്ങളും പ്രകൃതിയിൽ കാണപ്പെടുന്നില്ല, പക്ഷേ ലഭിക്കുന്നത് ആണവ പ്രതിപ്രവർത്തനങ്ങൾ; എന്നിരുന്നാലും, കൂടുതൽ വിദൂര ട്രാൻസ്യുറേനിയം മൂലകങ്ങളുടെ മേഖലയിൽ, വിളിക്കപ്പെടുന്നവയുടെ രൂപം. സ്ഥിരതയുടെ ദ്വീപുകൾ, പ്രത്യേകിച്ച് Z = 114.) കലയിൽ. ആനുകാലികമായി പുതിയ മൂലകങ്ങളുടെ സമന്വയം. നിയമവും പി.എസ്. ഇ. എം പ്രധാന പങ്ക് വഹിക്കുന്നു. മെൻഡലീവിൻ്റെ നിയമവും വ്യവസ്ഥയും പ്രകൃതി ശാസ്ത്രത്തിൻ്റെ ഏറ്റവും പ്രധാനപ്പെട്ട സാമാന്യവൽക്കരണങ്ങളിൽ ഒന്നാണ്, കൂടാതെ ആധുനിക ശാസ്ത്രത്തിൻ്റെ അടിത്തറയും. ദ്വീപിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള പഠിപ്പിക്കലുകൾ.
ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടന.
ഇതും അടുത്ത ഖണ്ഡികകളും ഒരു ആറ്റത്തിൻ്റെ ഇലക്ട്രോൺ ഷെല്ലിൻ്റെ മോഡലുകളെക്കുറിച്ച് സംസാരിക്കുന്നു. അത് മനസ്സിലാക്കേണ്ടത് പ്രധാനമാണ് ഞങ്ങൾ സംസാരിക്കുന്നത്കൃത്യമായി ഏകദേശം മോഡലുകൾ. യഥാർത്ഥ ആറ്റങ്ങൾ, തീർച്ചയായും, കൂടുതൽ സങ്കീർണ്ണമാണ്, അവയെക്കുറിച്ച് നമുക്ക് ഇപ്പോഴും എല്ലാം അറിയില്ല. എന്നിരുന്നാലും, ആധുനിക സൈദ്ധാന്തിക മാതൃക ഇലക്ട്രോണിക് ഘടനരാസ മൂലകങ്ങളുടെ പല ഗുണങ്ങളും വിജയകരമായി വിശദീകരിക്കാനും പ്രവചിക്കാനും ആറ്റം അനുവദിക്കുന്നു, അതിനാൽ ഇത് പ്രകൃതി ശാസ്ത്രത്തിൽ വ്യാപകമായി ഉപയോഗിക്കുന്നു.
ആരംഭിക്കുന്നതിന്, N. Bohr (ചിത്രം 2-3 c) നിർദ്ദേശിച്ച "പ്ലാനറ്ററി" മോഡൽ നമുക്ക് കൂടുതൽ വിശദമായി പരിഗണിക്കാം.

അരി. 2-3 സി. ബോറിൻ്റെ "പ്ലാനറ്ററി" മോഡൽ.
1913-ൽ ഡാനിഷ് ഭൗതികശാസ്ത്രജ്ഞനായ എൻ. ബോർ ആറ്റത്തിൻ്റെ ഒരു മാതൃക നിർദ്ദേശിച്ചു, അതിൽ ഇലക്ട്രോൺ കണികകൾ ആറ്റോമിക് ന്യൂക്ലിയസിന് ചുറ്റും കറങ്ങുന്നത് ഗ്രഹങ്ങൾ സൂര്യനെ ചുറ്റുന്നത് പോലെ തന്നെ. ഒരു ആറ്റത്തിലെ ഇലക്ട്രോണുകൾ നിശ്ചിത അകലത്തിൽ അണുകേന്ദ്രത്തിൽ നിന്ന് നീക്കം ചെയ്യപ്പെടുന്ന പരിക്രമണപഥങ്ങളിൽ മാത്രമേ സ്ഥിരമായി നിലനിൽക്കൂ എന്ന് ബോർ നിർദ്ദേശിച്ചു. ഈ ഭ്രമണപഥങ്ങളെ അദ്ദേഹം നിശ്ചലമെന്ന് വിളിച്ചു. നിശ്ചല ഭ്രമണപഥത്തിന് പുറത്ത് ഒരു ഇലക്ട്രോണിന് നിലനിൽക്കാൻ കഴിയില്ല. എന്തുകൊണ്ടാണ് ഇത് സംഭവിച്ചത്, ആ സമയത്ത് ബോറിന് വിശദീകരിക്കാൻ കഴിഞ്ഞില്ല. എന്നാൽ അത്തരമൊരു മാതൃക പല പരീക്ഷണാത്മക വസ്തുതകളും വിശദീകരിക്കാൻ ഒരാളെ അനുവദിക്കുന്നുവെന്ന് അദ്ദേഹം കാണിച്ചു (ഇത് ഖണ്ഡിക 2.7 ൽ കൂടുതൽ വിശദമായി ചർച്ചചെയ്യുന്നു).
ബോർ മോഡലിലെ ഇലക്ട്രോൺ പരിക്രമണപഥങ്ങൾ 1, 2, 3, ... എൻ, കാമ്പിനോട് ഏറ്റവും അടുത്തുള്ളതിൽ നിന്ന് ആരംഭിക്കുന്നു. ഇനിപ്പറയുന്നവയിൽ നമ്മൾ അത്തരം പരിക്രമണപഥങ്ങളെ വിളിക്കും ലെവലുകൾ. ഹൈഡ്രജൻ ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടന വിവരിക്കാൻ, അളവ് മാത്രം മതി. എന്നാൽ കൂടുതൽ സങ്കീർണ്ണമായ ആറ്റങ്ങളിൽ, അത് മാറിയതുപോലെ, ലെവലുകൾ സമാനമായ ഊർജ്ജങ്ങൾ ഉൾക്കൊള്ളുന്നു ഉപതലങ്ങൾ. ഉദാഹരണത്തിന്, ലെവൽ 2 രണ്ട് ഉപതലങ്ങൾ (2s, 2p) ഉൾക്കൊള്ളുന്നു. മൂന്നാമത്തെ ലെവലിൽ ചിത്രത്തിൽ കാണിച്ചിരിക്കുന്നതുപോലെ 3 ഉപ-തലങ്ങൾ (3s, 3p, 3d) അടങ്ങിയിരിക്കുന്നു. 2-6. നാലാമത്തെ ലെവലിൽ (ചിത്രത്തിൽ യോജിച്ചതല്ല) 4s, 4p, 4d, 4f എന്നീ ഉപതലങ്ങൾ അടങ്ങിയിരിക്കുന്നു. ഖണ്ഡിക 2.7 ൽ, ഈ ഉപതല പേരുകൾ എവിടെ നിന്നാണ് വന്നതെന്നും അതിനെക്കുറിച്ചും ഞങ്ങൾ നിങ്ങളോട് പറയും ശാരീരിക പരീക്ഷണങ്ങൾ, അത് ഞങ്ങളെ "കാണാൻ" അനുവദിച്ചു ഇലക്ട്രോണിക് ലെവലുകൾആറ്റങ്ങളിലെ ഉപതലങ്ങളും.

അരി. 2-6. ഹൈഡ്രജൻ ആറ്റത്തേക്കാൾ സങ്കീർണ്ണമായ ആറ്റങ്ങൾക്കുള്ള ബോറിൻ്റെ മാതൃക. ഡ്രോയിംഗ് സ്കെയിൽ ചെയ്യാനല്ല - വാസ്തവത്തിൽ, ഒരേ ലെവലിൻ്റെ ഉപതലങ്ങൾ പരസ്പരം വളരെ അടുത്താണ്.
ഏതൊരു ആറ്റത്തിൻ്റെയും ഇലക്ട്രോൺ ഷെല്ലിൽ അതിൻ്റെ ന്യൂക്ലിയസിൽ പ്രോട്ടോണുകൾ ഉള്ളത് പോലെ തന്നെ ഇലക്ട്രോണുകളും ഉണ്ട്, അതിനാൽ ആറ്റം മൊത്തത്തിൽ വൈദ്യുതപരമായി നിഷ്പക്ഷമാണ്. ഒരു ആറ്റത്തിലെ ഇലക്ട്രോണുകൾ ന്യൂക്ലിയസിനോട് ഏറ്റവും അടുത്തുള്ള ലെവലുകളും സബ്ലെവലുകളും നിറയ്ക്കുന്നു, കാരണം ഈ സാഹചര്യത്തിൽ അവയുടെ ഊർജ്ജം കൂടുതൽ വിദൂര തലങ്ങളിൽ ഉള്ളതിനേക്കാൾ കുറവാണ്. ഓരോ ലെവലിനും സബ് ലെവലിനും ഒരു നിശ്ചിത എണ്ണം ഇലക്ട്രോണുകൾ മാത്രമേ ഉൾക്കൊള്ളാൻ കഴിയൂ.
ഉപതലങ്ങൾ, അതാകട്ടെ, തുല്യ ഊർജ്ജം ഉൾക്കൊള്ളുന്നു പരിക്രമണപഥങ്ങൾ(അവ ചിത്രം 2-6 ൽ കാണിച്ചിട്ടില്ല). ആലങ്കാരികമായി പറഞ്ഞാൽ, ഒരു ആറ്റത്തിൻ്റെ ഇലക്ട്രോൺ മേഘത്തെ ഒരു നഗരവുമായോ തെരുവുമായോ താരതമ്യപ്പെടുത്തുകയാണെങ്കിൽ, ഒരു നിശ്ചിത ആറ്റത്തിൻ്റെ എല്ലാ ഇലക്ട്രോണുകളും "ജീവിക്കുന്ന", ഒരു ലെവലിനെ ഒരു വീടുമായോ ഒരു ഉപതലത്തെ ഒരു അപ്പാർട്ട്മെൻ്റുമായോ ഒരു പരിക്രമണത്തെ a ഇലക്ട്രോണുകൾക്കുള്ള മുറി. ഏത് ഉപതലത്തിലെയും എല്ലാ പരിക്രമണപഥങ്ങൾക്കും ഒരേ ഊർജ്ജമുണ്ട്. എസ്-സബ്ലെവലിൽ ഒരു "റൂം" മാത്രമേയുള്ളൂ - പരിക്രമണപഥം. p-sublevel-ന് 3 പരിക്രമണപഥങ്ങളും d-sublevel-ന് 5-ഉം f-sublevel-ന് 7 പരിക്രമണപഥങ്ങളുമുണ്ട്. ഓരോ "മുറി" പരിക്രമണപഥത്തിലും ഒന്നോ രണ്ടോ ഇലക്ട്രോണുകൾക്ക് "ജീവിക്കാൻ" കഴിയും. ഒരു പരിക്രമണപഥത്തിൽ രണ്ടിൽ കൂടുതൽ ഇലക്ട്രോണുകൾ ഉള്ളതിനെ നിരോധിക്കുന്നതിനെ വിളിക്കുന്നു പോളിയുടെ വിലക്ക്- ഇത് കണ്ടെത്തിയ ശാസ്ത്രജ്ഞൻ്റെ പേരിലാണ് പ്രധാന സവിശേഷതആറ്റത്തിൻ്റെ ഘടന. ഒരു ആറ്റത്തിലെ ഓരോ ഇലക്ട്രോണിനും അതിൻ്റേതായ "വിലാസം" ഉണ്ട്, അത് "ക്വാണ്ടം" എന്ന് വിളിക്കപ്പെടുന്ന നാല് സംഖ്യകളുടെ ഒരു കൂട്ടമായി എഴുതിയിരിക്കുന്നു. ക്വാണ്ടം സംഖ്യകൾ വിഭാഗം 2.7-ൽ വിശദമായി ചർച്ച ചെയ്യും. ഇവിടെ നമ്മൾ പ്രധാന ക്വാണ്ടം നമ്പർ മാത്രം പരാമർശിക്കും എൻ(ചിത്രം 2-6 കാണുക), ഇലക്ട്രോണിൻ്റെ "വിലാസത്തിൽ" ഈ ഇലക്ട്രോൺ നിലനിൽക്കുന്ന ലെവലിൻ്റെ എണ്ണം സൂചിപ്പിക്കുന്നു.
©2015-2019 സൈറ്റ്
എല്ലാ അവകാശങ്ങളും അവയുടെ രചയിതാക്കൾക്കുള്ളതാണ്. ഈ സൈറ്റ് കർത്തൃത്വം അവകാശപ്പെടുന്നില്ല, എന്നാൽ സൗജന്യ ഉപയോഗം നൽകുന്നു.
പേജ് സൃഷ്ടിച്ച തീയതി: 2016-08-20
നമുക്ക് ചുറ്റുമുള്ള ലോകം നിർമ്മിച്ചതാണ് രാസവസ്തുക്കൾ.
ഓരോ രാസ പദാർത്ഥത്തിൻ്റെയും ഗുണങ്ങളെ രണ്ട് തരങ്ങളായി തിരിച്ചിരിക്കുന്നു: രാസവസ്തുക്കൾ, മറ്റ് പദാർത്ഥങ്ങൾ രൂപപ്പെടുത്താനുള്ള കഴിവ്, ഭൗതികമായത്, വസ്തുനിഷ്ഠമായി നിരീക്ഷിക്കുകയും രാസ പരിവർത്തനങ്ങളിൽ നിന്ന് ഒറ്റപ്പെടുത്തുകയും ചെയ്യാം. ഉദാഹരണത്തിന്, ഒരു പദാർത്ഥത്തിൻ്റെ ഭൗതിക ഗുണങ്ങൾ അതിൻ്റെ സംയോജനാവസ്ഥ (ഖര, ദ്രാവക അല്ലെങ്കിൽ വാതകം), താപ ചാലകത, താപ ശേഷി, ലയിക്കുന്നതാണ് വ്യത്യസ്ത പരിതസ്ഥിതികൾ(വെള്ളം, മദ്യം മുതലായവ), സാന്ദ്രത, നിറം, രുചി മുതലായവ.
ചിലരുടെ രൂപാന്തരങ്ങൾ രാസ പദാർത്ഥങ്ങൾമറ്റ് പദാർത്ഥങ്ങളിൽ രാസ പ്രതിഭാസങ്ങൾ അല്ലെങ്കിൽ രാസപ്രവർത്തനങ്ങൾ എന്ന് വിളിക്കുന്നു. ചിലതിൽ പ്രത്യക്ഷമായും മാറ്റങ്ങളോടൊപ്പം ശാരീരിക പ്രതിഭാസങ്ങളും ഉണ്ടെന്ന് ശ്രദ്ധിക്കേണ്ടതാണ് ഭൌതിക ഗുണങ്ങൾപദാർത്ഥങ്ങൾ മറ്റ് പദാർത്ഥങ്ങളായി പരിവർത്തനം ചെയ്യപ്പെടാതെ. TO ശാരീരിക പ്രതിഭാസങ്ങൾ, ഉദാഹരണത്തിന്, മഞ്ഞ് ഉരുകൽ, ജലത്തിൻ്റെ മരവിപ്പിക്കൽ അല്ലെങ്കിൽ ബാഷ്പീകരണം മുതലായവ ഉൾപ്പെടുന്നു.
ഏതൊരു പ്രക്രിയയ്ക്കിടയിലും ഒരു രാസ പ്രതിഭാസം സംഭവിക്കുന്നു എന്ന വസ്തുത നിരീക്ഷിച്ചുകൊണ്ട് നിഗമനം ചെയ്യാം സ്വഭാവ സവിശേഷതകൾ രാസപ്രവർത്തനങ്ങൾ, നിറം മാറ്റം, അവശിഷ്ടം, വാതക പരിണാമം, ചൂട് കൂടാതെ/അല്ലെങ്കിൽ പ്രകാശം എന്നിവ പോലെ.
ഉദാഹരണത്തിന്, നിരീക്ഷിക്കുന്നതിലൂടെ രാസപ്രവർത്തനങ്ങളുടെ സംഭവത്തെക്കുറിച്ചുള്ള ഒരു നിഗമനത്തിൽ എത്തിച്ചേരാനാകും:
വെള്ളം തിളപ്പിക്കുമ്പോൾ അവശിഷ്ടത്തിൻ്റെ രൂപീകരണം, ദൈനംദിന ജീവിതത്തിൽ സ്കെയിൽ എന്ന് വിളിക്കുന്നു;
തീ കത്തുമ്പോൾ താപത്തിൻ്റെയും പ്രകാശത്തിൻ്റെയും പ്രകാശനം;
വായുവിൽ ഒരു ഫ്രഷ് ആപ്പിളിൻ്റെ നിറത്തിൽ മാറ്റം;
കുഴെച്ചതുമുതൽ അഴുകൽ സമയത്ത് വാതക കുമിളകളുടെ രൂപീകരണം.
രാസപ്രവർത്തനങ്ങളിൽ ഫലത്തിൽ മാറ്റങ്ങളൊന്നും സംഭവിക്കാത്തതും എന്നാൽ പരസ്പരം പുതിയ രീതിയിൽ മാത്രം ബന്ധിപ്പിക്കുന്നതുമായ ഒരു പദാർത്ഥത്തിൻ്റെ ഏറ്റവും ചെറിയ കണങ്ങളെ ആറ്റങ്ങൾ എന്ന് വിളിക്കുന്നു.
ദ്രവ്യത്തിൻ്റെ അത്തരം യൂണിറ്റുകളുടെ നിലനിൽപ്പിനെക്കുറിച്ചുള്ള ആശയം വീണ്ടും ഉയർന്നുവന്നു പുരാതന ഗ്രീസ്പുരാതന തത്ത്വചിന്തകരുടെ മനസ്സിൽ, "ആറ്റം" എന്ന പദത്തിൻ്റെ ഉത്ഭവം യഥാർത്ഥത്തിൽ വിശദീകരിക്കുന്നു, കാരണം ഗ്രീക്കിൽ നിന്ന് "അറ്റമോസ്" എന്നതിൻ്റെ അക്ഷരാർത്ഥത്തിൽ "അവിഭാജ്യമായത്" എന്നാണ് അർത്ഥമാക്കുന്നത്.
എന്നിരുന്നാലും, പുരാതന ഗ്രീക്ക് തത്ത്വചിന്തകരുടെ ആശയത്തിന് വിരുദ്ധമായി, ആറ്റങ്ങൾ ദ്രവ്യത്തിൻ്റെ സമ്പൂർണ്ണ മിനിമം അല്ല, അതായത്. അവയ്ക്ക് തന്നെ ഒരു സങ്കീർണ്ണ ഘടനയുണ്ട്.
ഓരോ ആറ്റത്തിലും സബ് ആറ്റോമിക് കണികകൾ എന്ന് വിളിക്കപ്പെടുന്നവ അടങ്ങിയിരിക്കുന്നു - പ്രോട്ടോണുകൾ, ന്യൂട്രോണുകൾ, ഇലക്ട്രോണുകൾ എന്നിവ യഥാക്രമം p +, n o, e - എന്നീ ചിഹ്നങ്ങളാൽ നിയുക്തമാക്കിയിരിക്കുന്നു. ഉപയോഗിച്ച നൊട്ടേഷനിലെ സൂപ്പർസ്ക്രിപ്റ്റ് സൂചിപ്പിക്കുന്നത് പ്രോട്ടോണിന് ഒരു യൂണിറ്റ് പോസിറ്റീവ് ചാർജ് ഉണ്ടെന്നും ഇലക്ട്രോണിന് ഒരു യൂണിറ്റ് നെഗറ്റീവ് ചാർജ് ഉണ്ടെന്നും ന്യൂട്രോണിന് ചാർജ് ഇല്ലെന്നും.
സംബന്ധിച്ചു ഗുണനിലവാരമുള്ള ഉപകരണംആറ്റം, പിന്നീട് ഓരോ ആറ്റത്തിനും എല്ലാ പ്രോട്ടോണുകളും ന്യൂട്രോണുകളും ന്യൂക്ലിയസ് എന്ന് വിളിക്കപ്പെടുന്നവയിൽ കേന്ദ്രീകരിച്ചിരിക്കുന്നു, അതിന് ചുറ്റും ഇലക്ട്രോണുകൾ ഒരു ഇലക്ട്രോൺ ഷെൽ ഉണ്ടാക്കുന്നു.
പ്രോട്ടോണിനും ന്യൂട്രോണിനും ഏതാണ്ട് ഒരേ പിണ്ഡമുണ്ട്, അതായത്. m p ≈ m n, ഇലക്ട്രോണിൻ്റെ പിണ്ഡം ഓരോന്നിൻ്റെയും പിണ്ഡത്തേക്കാൾ ഏകദേശം 2000 മടങ്ങ് കുറവാണ്, അതായത്. m p /m e ≈ m n /m e ≈ 2000.
ഒരു ആറ്റത്തിൻ്റെ അടിസ്ഥാന സ്വത്ത് അതിൻ്റെ വൈദ്യുത ന്യൂട്രാലിറ്റി ആയതിനാൽ, ഒരു ഇലക്ട്രോണിൻ്റെ ചാർജ് ഒരു പ്രോട്ടോണിൻ്റെ ചാർജിന് തുല്യമാണ്, ഇതിൽ നിന്ന് ഏത് ആറ്റത്തിലെയും ഇലക്ട്രോണുകളുടെ എണ്ണം പ്രോട്ടോണുകളുടെ എണ്ണത്തിന് തുല്യമാണെന്ന് നമുക്ക് നിഗമനം ചെയ്യാം.
ഉദാഹരണത്തിന്, ചുവടെയുള്ള പട്ടിക ആറ്റങ്ങളുടെ സാധ്യമായ ഘടന കാണിക്കുന്നു:
ഒരേ ന്യൂക്ലിയർ ചാർജ് ഉള്ള ആറ്റങ്ങളുടെ തരം, അതായത്. കൂടെ ഒരേ നമ്പർഅവയുടെ ന്യൂക്ലിയസുകളിലെ പ്രോട്ടോണുകളെ രാസ മൂലകം എന്ന് വിളിക്കുന്നു. അതിനാൽ, മുകളിലുള്ള പട്ടികയിൽ നിന്ന് ആറ്റം 1 ഉം ആറ്റം 2 ഉം ഒരു രാസ മൂലകത്തിനും ആറ്റം 3 ഉം ആറ്റം 4 ഉം മറ്റൊരു രാസ മൂലകത്തിൻ്റേതാണെന്ന് നിഗമനം ചെയ്യാം.
ഓരോ രാസ മൂലകത്തിനും അതിൻ്റേതായ പേരും വ്യക്തിഗത ചിഹ്നവുമുണ്ട്, അത് ഒരു പ്രത്യേക രീതിയിൽ വായിക്കുന്നു. ഉദാഹരണത്തിന്, ന്യൂക്ലിയസിൽ ഒരു പ്രോട്ടോൺ മാത്രം അടങ്ങിയിരിക്കുന്ന ഏറ്റവും ലളിതമായ രാസ മൂലകത്തെ "ഹൈഡ്രജൻ" എന്ന് വിളിക്കുന്നു, ഇത് "എച്ച്" എന്ന ചിഹ്നത്താൽ സൂചിപ്പിക്കുന്നു, ഇത് "ആഷ്" എന്നും ഒരു രാസ മൂലകവും ന്യൂക്ലിയർ ചാർജ് +7 (അതായത് 7 പ്രോട്ടോണുകൾ അടങ്ങിയിരിക്കുന്നു) - "നൈട്രജൻ", "N" എന്ന ചിഹ്നമുണ്ട്, അത് "en" എന്ന് വായിക്കുന്നു.
മുകളിലുള്ള പട്ടികയിൽ നിന്ന് നിങ്ങൾക്ക് കാണാനാകുന്നതുപോലെ, ഒരു രാസ മൂലകത്തിൻ്റെ ആറ്റങ്ങൾക്ക് അവയുടെ ന്യൂക്ലിയസുകളിലെ ന്യൂട്രോണുകളുടെ എണ്ണത്തിൽ വ്യത്യാസമുണ്ടാകാം.
ഒരേ രാസ മൂലകത്തിൽ പെട്ടതും എന്നാൽ ഉള്ളതുമായ ആറ്റങ്ങൾ വ്യത്യസ്ത അളവുകൾന്യൂട്രോണുകളും അതിൻ്റെ ഫലമായി പിണ്ഡത്തെ ഐസോടോപ്പുകൾ എന്ന് വിളിക്കുന്നു.
ഉദാഹരണത്തിന്, ഹൈഡ്രജൻ രാസ മൂലകത്തിന് മൂന്ന് ഐസോടോപ്പുകൾ ഉണ്ട് - 1 എച്ച്, 2 എച്ച്, 3 എച്ച്. എച്ച് ചിഹ്നത്തിന് മുകളിലുള്ള 1, 2, 3 സൂചികകൾ ന്യൂട്രോണുകളുടെയും പ്രോട്ടോണുകളുടെയും ആകെ എണ്ണത്തെ അർത്ഥമാക്കുന്നു. ആ. ഹൈഡ്രജൻ ഒരു രാസ മൂലകമാണെന്ന് അറിയുന്നത്, അതിൻ്റെ ആറ്റങ്ങളുടെ ന്യൂക്ലിയസുകളിൽ ഒരു പ്രോട്ടോൺ ഉണ്ടെന്നതിൻ്റെ സവിശേഷതയാണ്, 1 H ഐസോടോപ്പിൽ ന്യൂട്രോണുകളൊന്നുമില്ലെന്ന് നമുക്ക് നിഗമനം ചെയ്യാം (1-1 = 0), 2 H ഐസോടോപ്പ് - 1 ന്യൂട്രോൺ (2-1=1), 3 H ഐസോടോപ്പിൽ - രണ്ട് ന്യൂട്രോണുകൾ (3-1=2). ഇതിനകം സൂചിപ്പിച്ചതുപോലെ, ന്യൂട്രോണും പ്രോട്ടോണും ഒരേ പിണ്ഡമുള്ളതിനാൽ, ഇലക്ട്രോണിൻ്റെ പിണ്ഡം അവയുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ വളരെ ചെറുതാണ്, ഇതിനർത്ഥം 2 H ഐസോടോപ്പ് 1 H ഐസോടോപ്പിനേക്കാൾ ഇരട്ടി ഭാരമുള്ളതാണ്, കൂടാതെ 3 എച്ച് ഐസോടോപ്പ് മൂന്നിരട്ടി ഭാരമുള്ളതാണ്. ഹൈഡ്രജൻ ഐസോടോപ്പുകളുടെ പിണ്ഡത്തിൽ ഇത്രയും വലിയ ചിതറിക്കിടക്കുന്നതിനാൽ, ഐസോടോപ്പുകൾ 2 H, 3 H എന്നിവയ്ക്ക് പ്രത്യേക വ്യക്തിഗത പേരുകളും ചിഹ്നങ്ങളും നൽകിയിട്ടുണ്ട്, ഇത് മറ്റൊരു രാസ മൂലകത്തിനും സാധാരണമല്ല. 2H ഐസോടോപ്പിന് ഡ്യൂറ്റീരിയം എന്ന് പേര് നൽകി, അതിന് D എന്ന ചിഹ്നവും 3H ഐസോടോപ്പിന് ട്രിറ്റിയം എന്ന പേരും നൽകി T എന്ന ചിഹ്നവും നൽകി.
പ്രോട്ടോണിൻ്റെയും ന്യൂട്രോണിൻ്റെയും പിണ്ഡം ഒന്നായി എടുക്കുകയും ഇലക്ട്രോണിൻ്റെ പിണ്ഡം അവഗണിക്കുകയും ചെയ്താൽ, വാസ്തവത്തിൽ, ആറ്റത്തിലെ മൊത്തം പ്രോട്ടോണുകളുടെയും ന്യൂട്രോണുകളുടെയും എണ്ണം കൂടാതെ മുകളിലെ ഇടത് സൂചികയും അതിൻ്റെ പിണ്ഡമായി കണക്കാക്കാം, കൂടാതെ അതിനാൽ ഈ സൂചികയെ മാസ് നമ്പർ എന്ന് വിളിക്കുന്നു, ഇത് A എന്ന ചിഹ്നത്താൽ നിയുക്തമാക്കുന്നു. ഏതെങ്കിലും പ്രോട്ടോണുകളുടെ ന്യൂക്ലിയസിൻ്റെ ചാർജ് ആറ്റവുമായി പൊരുത്തപ്പെടുന്നതിനാൽ, ഓരോ പ്രോട്ടോണിൻ്റെയും ചാർജ് പരമ്പരാഗതമായി +1 ന് തുല്യമായി കണക്കാക്കപ്പെടുന്നു, ഇത് പ്രോട്ടോണുകളുടെ എണ്ണം ന്യൂക്ലിയസിനെ ചാർജ് നമ്പർ (Z) എന്ന് വിളിക്കുന്നു. ഒരു ആറ്റത്തിലെ ന്യൂട്രോണുകളുടെ എണ്ണം N ആയി സൂചിപ്പിക്കുന്നതിലൂടെ, മാസ് നമ്പർ, ചാർജ് നമ്പർ, ന്യൂട്രോണുകളുടെ എണ്ണം എന്നിവ തമ്മിലുള്ള ബന്ധം ഗണിതശാസ്ത്രപരമായി പ്രകടിപ്പിക്കാം:
ആധുനിക ആശയങ്ങൾ അനുസരിച്ച്, ഇലക്ട്രോണിന് ഇരട്ട (കണിക-തരംഗ) സ്വഭാവമുണ്ട്. ഇതിന് ഒരു കണത്തിൻ്റെയും തരംഗത്തിൻ്റെയും ഗുണങ്ങളുണ്ട്. ഒരു കണിക പോലെ, ഒരു ഇലക്ട്രോണിന് പിണ്ഡവും ചാർജും ഉണ്ട്, എന്നാൽ അതേ സമയം, ഇലക്ട്രോണുകളുടെ ഒഴുക്ക്, ഒരു തരംഗത്തെപ്പോലെ, വ്യതിചലനത്തിനുള്ള കഴിവാണ്.
ഒരു ആറ്റത്തിലെ ഇലക്ട്രോണിൻ്റെ അവസ്ഥ വിവരിക്കുന്നതിന്, ക്വാണ്ടം മെക്കാനിക്സിൻ്റെ ആശയങ്ങൾ ഉപയോഗിക്കുന്നു, അതനുസരിച്ച് ഇലക്ട്രോണിന് ഒരു പ്രത്യേക ചലന പാതയില്ല, ബഹിരാകാശത്ത് ഏത് ഘട്ടത്തിലും സ്ഥിതിചെയ്യാം, പക്ഷേ വ്യത്യസ്ത സാധ്യതകളോടെ.
ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള സ്ഥലത്തിൻ്റെ ഒരു ഇലക്ട്രോൺ കണ്ടെത്താൻ സാധ്യതയുള്ള പ്രദേശത്തെ ആറ്റോമിക് ഓർബിറ്റൽ എന്ന് വിളിക്കുന്നു.
ഒരു ആറ്റോമിക് പരിക്രമണപഥത്തിന് ഉണ്ടാകാം വിവിധ രൂപങ്ങൾ, വലിപ്പവും ഓറിയൻ്റേഷനും. ഒരു ആറ്റോമിക് ഓർബിറ്റലിനെ ഇലക്ട്രോൺ മേഘം എന്നും വിളിക്കുന്നു.
ഗ്രാഫിക്കലായി, ഒരു ആറ്റോമിക് ഓർബിറ്റലിനെ സാധാരണയായി ഒരു ചതുര കോശമായി സൂചിപ്പിക്കുന്നു:
ക്വാണ്ടം മെക്കാനിക്സിന് വളരെ സങ്കീർണ്ണമായ ഒരു ഗണിതശാസ്ത്ര ഉപകരണമുണ്ട്, അതിനാൽ, ഒരു സ്കൂൾ കെമിസ്ട്രി കോഴ്സിൻ്റെ ചട്ടക്കൂടിൽ, ക്വാണ്ടം മെക്കാനിക്കൽ സിദ്ധാന്തത്തിൻ്റെ അനന്തരഫലങ്ങൾ മാത്രമേ പരിഗണിക്കൂ.
ഈ പരിണതഫലങ്ങൾ അനുസരിച്ച്, ഏത് ആറ്റോമിക് പരിക്രമണപഥവും അതിൽ സ്ഥിതി ചെയ്യുന്ന ഇലക്ട്രോണും 4 ക്വാണ്ടം സംഖ്യകളാൽ പൂർണ്ണമായി വിശേഷിപ്പിക്കപ്പെടുന്നു.
- പ്രധാന ക്വാണ്ടം നമ്പർ, n, ഒരു നിശ്ചിത പരിക്രമണപഥത്തിലെ ഇലക്ട്രോണിൻ്റെ മൊത്തം ഊർജ്ജം നിർണ്ണയിക്കുന്നു. പ്രധാന ക്വാണ്ടം സംഖ്യയുടെ മൂല്യങ്ങളുടെ ശ്രേണി - എല്ലാം പൂർണ്ണസംഖ്യകൾ, അതായത്. n = 1,2,3,4, 5, മുതലായവ.
- പരിക്രമണ ക്വാണ്ടം നമ്പർ - l - ആറ്റോമിക് ഓർബിറ്റലിൻ്റെ ആകൃതിയെ വിശേഷിപ്പിക്കുന്നു, കൂടാതെ 0 മുതൽ n-1 വരെയുള്ള ഏത് പൂർണ്ണസംഖ്യയും എടുക്കാം, ഇവിടെ n, റീകോൾ, പ്രധാന ക്വാണ്ടം സംഖ്യയാണ്.
l = 0 ഉള്ള പരിക്രമണങ്ങളെ വിളിക്കുന്നു എസ്- പരിക്രമണപഥങ്ങൾ. s-ഓർബിറ്റലുകൾ ഗോളാകൃതിയിലുള്ളതും ബഹിരാകാശത്ത് ദിശാബോധം ഇല്ലാത്തതുമാണ്:
l = 1 ഉള്ള പരിക്രമണങ്ങളെ വിളിക്കുന്നു പി- പരിക്രമണപഥങ്ങൾ. ഈ പരിക്രമണപഥങ്ങൾക്ക് ത്രിമാന രൂപമായ എട്ടിൻ്റെ ആകൃതിയുണ്ട്, അതായത്. ഒരു സമമിതിയുടെ അച്ചുതണ്ടിന് ചുറ്റും എട്ട് അങ്കം തിരിക്കുന്നതിലൂടെ ലഭിക്കുന്ന ഒരു ആകൃതി, ബാഹ്യമായി ഒരു ഡംബെല്ലിനോട് സാമ്യമുണ്ട്:
l = 2 ഉള്ള പരിക്രമണങ്ങളെ വിളിക്കുന്നു ഡി- പരിക്രമണപഥങ്ങൾ, ഒപ്പം l = 3 - എഫ്- പരിക്രമണപഥങ്ങൾ. അവയുടെ ഘടന കൂടുതൽ സങ്കീർണ്ണമാണ്.
3) കാന്തിക ക്വാണ്ടം നമ്പർ - m l - ഒരു പ്രത്യേക ആറ്റോമിക് പരിക്രമണപഥത്തിൻ്റെ സ്പേഷ്യൽ ഓറിയൻ്റേഷൻ നിർണ്ണയിക്കുകയും ദിശയിലേക്ക് പരിക്രമണ കോണീയ ആക്കം കൂട്ടുന്നതിൻ്റെ പ്രൊജക്ഷൻ പ്രകടിപ്പിക്കുകയും ചെയ്യുന്നു. കാന്തികക്ഷേത്രം. കാന്തിക ക്വാണ്ടം നമ്പർ m l, ബാഹ്യ കാന്തികക്ഷേത്ര ശക്തി വെക്ടറിൻ്റെ ദിശയുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ പരിക്രമണത്തിൻ്റെ ഓറിയൻ്റേഷനുമായി പൊരുത്തപ്പെടുന്നു, കൂടാതെ 0 ഉൾപ്പെടെ -l മുതൽ +l വരെയുള്ള ഏത് പൂർണ്ണസംഖ്യയും എടുക്കാം, അതായത്. സാധ്യമായ മൂല്യങ്ങളുടെ ആകെ എണ്ണം (2l+1) ആണ്. ഉദാഹരണത്തിന്, l = 0 m l = 0 (ഒരു മൂല്യം), l = 1 m l = -1, 0, +1 (മൂന്ന് മൂല്യങ്ങൾ), l = 2 m l = -2, -1, 0, + 1, +2 (കാന്തിക ക്വാണ്ടം സംഖ്യയുടെ അഞ്ച് മൂല്യങ്ങൾ) മുതലായവ.
അതിനാൽ, ഉദാഹരണത്തിന്, പി-ഓർബിറ്റലുകൾ, അതായത്. ഒരു പരിക്രമണ ക്വാണ്ടം നമ്പർ l = 1 ഉള്ള പരിക്രമണപഥങ്ങൾ, "എട്ടിൻ്റെ ത്രിമാന രൂപത്തിൻ്റെ" ആകൃതിയിലുള്ള, കാന്തിക ക്വാണ്ടം സംഖ്യയുടെ (-1, 0, +1) മൂന്ന് മൂല്യങ്ങളുമായി പൊരുത്തപ്പെടുന്നു, അത്, ബഹിരാകാശത്ത് പരസ്പരം ലംബമായി മൂന്ന് ദിശകളുമായി പൊരുത്തപ്പെടുന്നു.
4) സ്പിൻ ക്വാണ്ടം നമ്പർ (അല്ലെങ്കിൽ സ്പിൻ) - m s - പരമ്പരാഗതമായി ആറ്റത്തിലെ ഇലക്ട്രോണിൻ്റെ ഭ്രമണ ദിശയ്ക്ക് ഉത്തരവാദിയായി കണക്കാക്കാം; അതിന് മൂല്യങ്ങൾ എടുക്കാം. വ്യത്യസ്ത സ്പിന്നുകളുള്ള ഇലക്ട്രോണുകൾ ലംബമായ അമ്പടയാളങ്ങളാൽ സൂചിപ്പിക്കപ്പെടുന്നു വ്യത്യസ്ത വശങ്ങൾ: ↓ കൂടാതെ .
ഒരേ പ്രധാന ക്വാണ്ടം സംഖ്യയുള്ള ഒരു ആറ്റത്തിലെ എല്ലാ പരിക്രമണപഥങ്ങളുടെയും ഗണത്തെ ഊർജ്ജ നില അല്ലെങ്കിൽ ഇലക്ട്രോൺ ഷെൽ എന്ന് വിളിക്കുന്നു. ഏതെങ്കിലും ഏകപക്ഷീയമായ ഊർജ്ജ നിലചില സംഖ്യകൾ n-ൽ n 2 പരിക്രമണങ്ങൾ അടങ്ങിയിരിക്കുന്നു.
പ്രധാന ക്വാണ്ടം സംഖ്യയുടെയും പരിക്രമണ ക്വാണ്ടം സംഖ്യയുടെയും ഒരേ മൂല്യങ്ങളുള്ള ഒരു കൂട്ടം പരിക്രമണപഥങ്ങൾ ഒരു ഊർജ്ജ ഉപതലത്തെ പ്രതിനിധീകരിക്കുന്നു.
പ്രധാന ക്വാണ്ടം സംഖ്യയായ n ന് യോജിക്കുന്ന ഓരോ ഊർജ്ജ നിലയിലും n ഉപതലങ്ങൾ അടങ്ങിയിരിക്കുന്നു. പരിക്രമണ ക്വാണ്ടം നമ്പർ l ഉള്ള ഓരോ ഊർജ്ജ ഉപതലത്തിലും (2l+1) പരിക്രമണപഥങ്ങൾ അടങ്ങിയിരിക്കുന്നു. അങ്ങനെ, s ഉപതലത്തിൽ ഒരു s പരിക്രമണവും p ഉപതലത്തിൽ മൂന്ന് p പരിക്രമണപഥങ്ങളും, d ഉപതലത്തിൽ അഞ്ച് d പരിക്രമണപഥങ്ങളും, f ഉപതലത്തിൽ ഏഴ് f പരിക്രമണപഥങ്ങളും അടങ്ങിയിരിക്കുന്നു. ഇതിനകം സൂചിപ്പിച്ചതുപോലെ, ഒരു ആറ്റോമിക് പരിക്രമണപഥത്തെ പലപ്പോഴും ഒരു ചതുര കോശത്താൽ സൂചിപ്പിക്കുന്നു എന്നതിനാൽ, s-, p-, d-, f- ഉപതലങ്ങളെ ഗ്രാഫിക്കായി ഇനിപ്പറയുന്ന രീതിയിൽ പ്രതിനിധീകരിക്കാം:
ഓരോ പരിക്രമണപഥവും n, l, m l എന്നീ മൂന്ന് ക്വാണ്ടം സംഖ്യകളുടെ വ്യക്തിഗത കർശനമായി നിർവചിച്ചിരിക്കുന്ന സെറ്റുമായി യോജിക്കുന്നു.
ഓർബിറ്റലുകൾക്കിടയിൽ ഇലക്ട്രോണുകളുടെ വിതരണത്തെ ഇലക്ട്രോൺ കോൺഫിഗറേഷൻ എന്ന് വിളിക്കുന്നു.
ഇലക്ട്രോണുകൾ ഉപയോഗിച്ച് ആറ്റോമിക് ഓർബിറ്റലുകൾ പൂരിപ്പിക്കുന്നത് മൂന്ന് വ്യവസ്ഥകൾക്കനുസൃതമായി സംഭവിക്കുന്നു:
- കുറഞ്ഞ ഊർജ്ജ തത്വം: ഇലക്ട്രോണുകൾ ഏറ്റവും താഴ്ന്ന ഊർജ്ജ ഉപതലത്തിൽ നിന്ന് ആരംഭിക്കുന്ന പരിക്രമണപഥങ്ങളെ നിറയ്ക്കുന്നു. ഉപതലങ്ങളുടെ ക്രമം അവയുടെ ഊർജ്ജങ്ങളുടെ ക്രമം ഇപ്രകാരമാണ്: 1 സെ<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
ഇലക്ട്രോണിക് സബ്ലെവലുകൾ പൂരിപ്പിക്കുന്നതിൻ്റെ ഈ ക്രമം ഓർമ്മിക്കുന്നത് എളുപ്പമാക്കുന്നതിന്, ഇനിപ്പറയുന്ന ഗ്രാഫിക് ചിത്രീകരണം വളരെ സൗകര്യപ്രദമാണ്:
- പോളി തത്വം: ഓരോ പരിക്രമണപഥത്തിലും രണ്ടിൽ കൂടുതൽ ഇലക്ട്രോണുകൾ അടങ്ങിയിരിക്കരുത്.
ഒരു പരിക്രമണപഥത്തിൽ ഒരു ഇലക്ട്രോൺ ഉണ്ടെങ്കിൽ, അതിനെ ജോടിയാക്കാത്തത് എന്നും രണ്ടെണ്ണം ഉണ്ടെങ്കിൽ അവയെ ഇലക്ട്രോൺ ജോഡി എന്നും വിളിക്കുന്നു.
- ഹണ്ടിൻ്റെ ഭരണം: ഒരു ആറ്റത്തിൻ്റെ ഏറ്റവും സ്ഥിരതയുള്ള അവസ്ഥ, ഒരു ഉപതലത്തിൽ, ആറ്റത്തിന് ജോടിയാക്കാത്ത ഇലക്ട്രോണുകളുടെ പരമാവധി എണ്ണം ഉണ്ട്. ആറ്റത്തിൻ്റെ ഏറ്റവും സ്ഥിരതയുള്ള ഈ അവസ്ഥയെ ഗ്രൗണ്ട് സ്റ്റേറ്റ് എന്ന് വിളിക്കുന്നു.
വാസ്തവത്തിൽ, മുകളിൽ പറഞ്ഞവ അർത്ഥമാക്കുന്നത്, ഉദാഹരണത്തിന്, പി-സബ്ലെവലിൻ്റെ മൂന്ന് പരിക്രമണപഥങ്ങളിൽ 1, 2, 3, 4 ഇലക്ട്രോണുകൾ സ്ഥാപിക്കുന്നത് ഇനിപ്പറയുന്ന രീതിയിൽ നടപ്പിലാക്കും എന്നാണ്:
ചാർജ് നമ്പർ 1 ഉള്ള ഹൈഡ്രജനിൽ നിന്ന് 36 ചാർജ്ജുള്ള ക്രിപ്റ്റോണിലേക്ക് (Kr) ആറ്റോമിക് ഓർബിറ്റലുകൾ പൂരിപ്പിക്കുന്നത് ഇനിപ്പറയുന്ന രീതിയിൽ നടപ്പിലാക്കും:
ആറ്റോമിക് ഓർബിറ്റലുകളുടെ പൂരിപ്പിക്കൽ ക്രമത്തിൻ്റെ അത്തരം പ്രതിനിധാനത്തെ ഊർജ്ജ ഡയഗ്രം എന്ന് വിളിക്കുന്നു. വ്യക്തിഗത മൂലകങ്ങളുടെ ഇലക്ട്രോണിക് ഡയഗ്രമുകളെ അടിസ്ഥാനമാക്കി, അവയുടെ ഇലക്ട്രോണിക് ഫോർമുലകൾ (കോൺഫിഗറേഷനുകൾ) എന്ന് വിളിക്കുന്നത് എഴുതാൻ കഴിയും. ഉദാഹരണത്തിന്, 15 പ്രോട്ടോണുകളുള്ള ഒരു മൂലകവും, അനന്തരഫലമായി, 15 ഇലക്ട്രോണുകളും, അതായത്. ഫോസ്ഫറസിന് (P) ഇനിപ്പറയുന്ന ഊർജ്ജ ഡയഗ്രം ഉണ്ടായിരിക്കും:
ഒരു ഇലക്ട്രോണിക് ഫോർമുലയിലേക്ക് പരിവർത്തനം ചെയ്യുമ്പോൾ, ഫോസ്ഫറസ് ആറ്റം രൂപമെടുക്കും:
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
സബ്ലെവൽ ചിഹ്നത്തിൻ്റെ ഇടതുവശത്തുള്ള സാധാരണ വലുപ്പ സംഖ്യകൾ എനർജി ലെവൽ നമ്പറും സബ്ലെവൽ ചിഹ്നത്തിൻ്റെ വലതുവശത്തുള്ള സൂപ്പർസ്ക്രിപ്റ്റുകൾ അനുബന്ധ സബ്ലെവലിലെ ഇലക്ട്രോണുകളുടെ എണ്ണവും കാണിക്കുന്നു.
D.I പ്രകാരം ആവർത്തനപ്പട്ടികയിലെ ആദ്യത്തെ 36 മൂലകങ്ങളുടെ ഇലക്ട്രോണിക് ഫോർമുലകൾ ചുവടെയുണ്ട്. മെൻഡലീവ്.
| കാലഘട്ടം | ഐറ്റം നമ്പർ. | ചിഹ്നം | പേര് | ഇലക്ട്രോണിക് ഫോർമുല |
| ഐ | 1 | എച്ച് | ഹൈഡ്രജൻ | 1സെ 1 |
| 2 | അവൻ | ഹീലിയം | 1 സെ 2 | |
| II | 3 | ലി | ലിഥിയം | 1സെ 2 2 സെ 1 |
| 4 | ആകുക | ബെറിലിയം | 1സെ 2 2 സെ 2 | |
| 5 | ബി | ബോറോൺ | 1s 2 2s 2 2p 1 | |
| 6 | സി | കാർബൺ | 1s 2 2s 2 2p 2 | |
| 7 | എൻ | നൈട്രജൻ | 1സെ 2 2 സെ 2 2 പി 3 | |
| 8 | ഒ | ഓക്സിജൻ | 1s 2 2s 2 2p 4 | |
| 9 | എഫ് | ഫ്ലൂറിൻ | 1s 2 2s 2 2p 5 | |
| 10 | നെ | നിയോൺ | 1s 2 2s 2 2p 6 | |
| III | 11 | നാ | സോഡിയം | 1s 2 2s 2 2p 6 3s 1 |
| 12 | എം.ജി | മഗ്നീഷ്യം | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | അൽ | അലുമിനിയം | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | എസ്.ഐ | സിലിക്കൺ | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | പി | ഫോസ്ഫറസ് | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | എസ് | സൾഫർ | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | ക്ലോറിൻ | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | ആർഗോൺ | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | കെ | പൊട്ടാസ്യം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | ഏകദേശം | കാൽസ്യം | 1സെ 2 2 സെ 2 2 പി 6 3 സെ 2 3 പി 6 4 സെ 2 | |
| 21 | എസ്.സി | സ്കാൻഡിയം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | ടി | ടൈറ്റാനിയം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | വി | വനേഡിയം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | ക്രോമിയം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 ഇവിടെ നമ്മൾ ഒരു ഇലക്ട്രോണിൻ്റെ കുതിപ്പ് നിരീക്ഷിക്കുന്നു എസ്ഓൺ ഡിഉപതലം | |
| 25 | എം.എൻ | മാംഗനീസ് | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | ഫെ | ഇരുമ്പ് | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | കോ | കൊബാൾട്ട് | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | നി | നിക്കൽ | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | ക്യൂ | ചെമ്പ് | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 ഇവിടെ നമ്മൾ ഒരു ഇലക്ട്രോണിൻ്റെ കുതിപ്പ് നിരീക്ഷിക്കുന്നു എസ്ഓൺ ഡിഉപതലം | |
| 30 | Zn | സിങ്ക് | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | ഗ | ഗാലിയം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | ജി | ജെർമേനിയം | 1സെ 2 2 സെ 2 2 പി 6 3 സെ 2 3 പി 6 4 സെ 2 3 ഡി 10 4 പി 2 | |
| 33 | പോലെ | ആഴ്സനിക് | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | സെ | സെലിനിയം | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | ബ്രോമിൻ | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | ക്രിപ്റ്റോൺ | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
ഇതിനകം സൂചിപ്പിച്ചതുപോലെ, അവയുടെ ഗ്രൗണ്ട് സ്റ്റേറ്റിൽ, ആറ്റോമിക് ഓർബിറ്റലുകളിലെ ഇലക്ട്രോണുകൾ കുറഞ്ഞത് ഊർജ്ജത്തിൻ്റെ തത്വമനുസരിച്ച് സ്ഥിതിചെയ്യുന്നു. എന്നിരുന്നാലും, ആറ്റത്തിൻ്റെ ഗ്രൗണ്ട് സ്റ്റേറ്റിലെ ശൂന്യമായ പി-ഓർബിറ്റലുകളുടെ സാന്നിധ്യത്തിൽ, പലപ്പോഴും, അധിക ഊർജ്ജം നൽകിക്കൊണ്ട്, ആറ്റത്തെ ആവേശഭരിതമായ അവസ്ഥയിലേക്ക് മാറ്റാൻ കഴിയും. ഉദാഹരണത്തിന്, ഒരു ബോറോൺ ആറ്റത്തിന് അതിൻ്റെ ഗ്രൗണ്ട് സ്റ്റേറ്റിൽ ഒരു ഇലക്ട്രോണിക് കോൺഫിഗറേഷനും ഇനിപ്പറയുന്ന രൂപത്തിൻ്റെ ഒരു ഊർജ്ജ ഡയഗ്രവും ഉണ്ട്:
5 B = 1s 2 2s 2 2p 1
ഒരു ആവേശകരമായ അവസ്ഥയിൽ (*), അതായത്. ഒരു ബോറോൺ ആറ്റത്തിന് കുറച്ച് ഊർജ്ജം നൽകുമ്പോൾ, അതിൻ്റെ ഇലക്ട്രോൺ കോൺഫിഗറേഷനും ഊർജ്ജ രേഖാചിത്രവും ഇതുപോലെ കാണപ്പെടും:
5 B* = 1s 2 2s 1 2p 2
ആറ്റത്തിലെ ഏത് ഉപതലം അവസാനമായി നിറഞ്ഞിരിക്കുന്നു എന്നതിനെ ആശ്രയിച്ച്, രാസ മൂലകങ്ങളെ s, p, d അല്ലെങ്കിൽ f എന്നിങ്ങനെ തിരിച്ചിരിക്കുന്നു.
പട്ടികയിൽ s, p, d, f ഘടകങ്ങൾ കണ്ടെത്തുന്നു D.I. മെൻഡലീവ്:
- s-ഘടകങ്ങൾക്ക് പൂരിപ്പിക്കേണ്ട അവസാന s-സബ്ലെവൽ ഉണ്ട്. ഈ ഘടകങ്ങളിൽ I, II ഗ്രൂപ്പുകളുടെ പ്രധാന (ടേബിൾ സെല്ലിൽ ഇടതുവശത്ത്) ഉപഗ്രൂപ്പുകളുടെ ഘടകങ്ങൾ ഉൾപ്പെടുന്നു.
- പി-എലമെൻ്റുകൾക്ക്, പി-സബ്ലെവൽ നിറഞ്ഞിരിക്കുന്നു. പി-എലമെൻ്റുകളിൽ ആദ്യത്തേതും ഏഴാമത്തേതും ഒഴികെയുള്ള ഓരോ കാലഘട്ടത്തിലെയും അവസാനത്തെ ആറ് ഘടകങ്ങളും III-VIII ഗ്രൂപ്പുകളുടെ പ്രധാന ഉപഗ്രൂപ്പുകളുടെ ഘടകങ്ങളും ഉൾപ്പെടുന്നു.
- d-മൂലകങ്ങൾ വലിയ കാലയളവുകളിൽ s- നും p- മൂലകങ്ങൾക്കും ഇടയിലാണ് സ്ഥിതി ചെയ്യുന്നത്.
- എഫ്-മൂലകങ്ങളെ ലാന്തനൈഡുകൾ എന്നും ആക്ടിനൈഡുകൾ എന്നും വിളിക്കുന്നു. അവ D.I പട്ടികയുടെ ചുവടെ പട്ടികപ്പെടുത്തിയിരിക്കുന്നു. മെൻഡലീവ്.
രാസപ്രവർത്തനങ്ങളിൽ പ്രതിപ്രവർത്തിക്കുന്ന ആറ്റങ്ങളുടെ അണുകേന്ദ്രങ്ങൾ മാറ്റമില്ലാതെ തുടരുന്നതിനാൽ (റേഡിയോ ആക്ടീവ് പരിവർത്തനങ്ങൾ ഒഴികെ), ആറ്റങ്ങളുടെ രാസ ഗുണങ്ങൾ അവയുടെ ഇലക്ട്രോണിക് ഷെല്ലുകളുടെ ഘടനയെ ആശ്രയിച്ചിരിക്കുന്നു. സിദ്ധാന്തം ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടനക്വാണ്ടം മെക്കാനിക്സിൻ്റെ ഉപകരണത്തിൻ്റെ അടിസ്ഥാനത്തിലാണ് നിർമ്മിച്ചിരിക്കുന്നത്. അതിനാൽ, ആറ്റോമിക് ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള സ്ഥലത്ത് ഇലക്ട്രോണുകൾ കണ്ടെത്തുന്നതിനുള്ള സാധ്യതകളുടെ ക്വാണ്ടം മെക്കാനിക്കൽ കണക്കുകൂട്ടലുകളുടെ അടിസ്ഥാനത്തിൽ ആറ്റോമിക് എനർജി ലെവലുകളുടെ ഘടന ലഭിക്കും ( അരി. 4.5).
അരി. 4.5. ഊർജ്ജ നിലകളെ ഉപതലങ്ങളായി വിഭജിക്കുന്ന പദ്ധതി
ഒരു ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടനയെക്കുറിച്ചുള്ള സിദ്ധാന്തത്തിൻ്റെ അടിസ്ഥാനങ്ങൾ ഇനിപ്പറയുന്ന വ്യവസ്ഥകളിലേക്ക് ചുരുക്കിയിരിക്കുന്നു: ഒരു ആറ്റത്തിലെ ഓരോ ഇലക്ട്രോണിൻ്റെയും അവസ്ഥ നാല് ക്വാണ്ടം സംഖ്യകളാൽ സവിശേഷതയാണ്: പ്രധാന ക്വാണ്ടം നമ്പർ n = 1, 2, 3,; പരിക്രമണം (അസിമുതൽ) l=0,1,2, n–1; കാന്തിക എം എൽ =-l, –1,0,1, എൽ; കറങ്ങുക എം എസ് = -1/2, 1/2 .
ഇതനുസരിച്ച് പോളി തത്വം, ഒരേ ആറ്റത്തിൽ ഒരേ സെറ്റ് നാല് ക്വാണ്ടം സംഖ്യകളുള്ള രണ്ട് ഇലക്ട്രോണുകൾ ഉണ്ടാകരുത് n, l, m എൽ , എം എസ്; ഒരേ പ്രധാന ക്വാണ്ടം സംഖ്യകളുള്ള ഇലക്ട്രോണുകളുടെ ശേഖരം ഇലക്ട്രോൺ പാളികൾ രൂപപ്പെടുത്തുന്നു, അല്ലെങ്കിൽ ആറ്റത്തിൻ്റെ ഊർജ്ജ നിലകൾ, ന്യൂക്ലിയസിൽ നിന്ന് അക്കമിട്ട് സൂചിപ്പിക്കുന്നത് കെ, എൽ, എം, എൻ, ഒ, പി, ക്യു, ഒരു നിശ്ചിത മൂല്യമുള്ള ഊർജ്ജ പാളിയിലും എൻഅതിൽ കൂടുതലാകാൻ കഴിയില്ല 2n 2 ഇലക്ട്രോണുകൾ. ഒരേ ക്വാണ്ടം സംഖ്യകളുള്ള ഇലക്ട്രോണുകളുടെ ശേഖരം എൻഒപ്പം എൽ, ഫോം സബ്ലെവലുകൾ, അവ കാമ്പിൽ നിന്ന് അകന്നുപോകുമ്പോൾ നിയുക്തമാക്കിയിരിക്കുന്നു s, p, d, f.
ആറ്റോമിക് ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള ബഹിരാകാശത്ത് ഇലക്ട്രോണിൻ്റെ സ്ഥാനത്തിൻ്റെ പ്രോബബിലിസ്റ്റിക് നിർണ്ണയം ഹൈസൻബർഗിൻ്റെ അനിശ്ചിതത്വ തത്വവുമായി യോജിക്കുന്നു. ക്വാണ്ടം മെക്കാനിക്കൽ ആശയങ്ങൾ അനുസരിച്ച്, ഒരു ആറ്റത്തിലെ ഒരു ഇലക്ട്രോണിന് ഒരു പ്രത്യേക ചലന പാതയില്ല, ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള സ്ഥലത്തിൻ്റെ ഏത് ഭാഗത്തും സ്ഥിതിചെയ്യാം, അതിൻ്റെ വിവിധ സ്ഥാനങ്ങൾ ഒരു നിശ്ചിത നെഗറ്റീവ് ചാർജ് സാന്ദ്രതയുള്ള ഇലക്ട്രോൺ മേഘമായി കണക്കാക്കപ്പെടുന്നു. ഒരു ഇലക്ട്രോൺ കണ്ടെത്താൻ സാധ്യതയുള്ള ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള സ്ഥലത്തെ വിളിക്കുന്നു പരിക്രമണപഥം. ഇലക്ട്രോൺ മേഘത്തിൻ്റെ 90 ശതമാനവും ഇതിൽ അടങ്ങിയിരിക്കുന്നു. ഓരോ ഉപതലം 1സെ, 2സെ, 2പിതുടങ്ങിയവ. ഒരു നിശ്ചിത ആകൃതിയിലുള്ള ഒരു നിശ്ചിത എണ്ണം പരിക്രമണപഥങ്ങളുമായി പൊരുത്തപ്പെടുന്നു. ഉദാഹരണത്തിന്, 1സെ- ഒപ്പം 2സെ-പരിക്രമണപഥങ്ങൾ ഗോളാകൃതിയും 2p-ഓർബിറ്റലുകൾ ( 2p x , 2p വൈ , 2p z-ഓർബിറ്റലുകൾ) പരസ്പരം ലംബമായ ദിശകളിൽ അധിഷ്ഠിതമാണ്, കൂടാതെ ഒരു ഡംബെല്ലിൻ്റെ ആകൃതിയും ഉണ്ട് ( അരി. 4.6).

അരി. 4.6. ഇലക്ട്രോൺ ഓർബിറ്റലുകളുടെ ആകൃതിയും ഓറിയൻ്റേഷനും.
രാസപ്രവർത്തന സമയത്ത്, ആറ്റോമിക് ന്യൂക്ലിയസ് മാറ്റങ്ങൾക്ക് വിധേയമാകില്ല; ആറ്റങ്ങളുടെ ഇലക്ട്രോണിക് ഷെല്ലുകൾ മാത്രമേ മാറുന്നുള്ളൂ, ഇതിൻ്റെ ഘടന രാസ മൂലകങ്ങളുടെ പല ഗുണങ്ങളും വിശദീകരിക്കുന്നു. ആറ്റത്തിൻ്റെ ഇലക്ട്രോണിക് ഘടനയുടെ സിദ്ധാന്തത്തെ അടിസ്ഥാനമാക്കി, മെൻഡലീവിൻ്റെ രാസ മൂലകങ്ങളുടെ ആനുകാലിക നിയമത്തിൻ്റെ ആഴത്തിലുള്ള ഭൗതിക അർത്ഥം സ്ഥാപിക്കുകയും കെമിക്കൽ ബോണ്ടിംഗ് സിദ്ധാന്തം സൃഷ്ടിക്കുകയും ചെയ്തു.
രാസ മൂലകങ്ങളുടെ ആനുകാലിക സംവിധാനത്തിൻ്റെ സൈദ്ധാന്തിക ന്യായീകരണത്തിൽ ആറ്റത്തിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള ഡാറ്റ ഉൾപ്പെടുന്നു, രാസ മൂലകങ്ങളുടെ ഗുണങ്ങളിലെ മാറ്റങ്ങളുടെ ആനുകാലികതയും അവയുടെ ആറ്റങ്ങളുടെ സമാന തരം ഇലക്ട്രോണിക് കോൺഫിഗറേഷനുകളുടെ ആനുകാലിക ആവർത്തനവും തമ്മിലുള്ള ബന്ധത്തിൻ്റെ അസ്തിത്വം സ്ഥിരീകരിക്കുന്നു.
ആറ്റത്തിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള സിദ്ധാന്തത്തിൻ്റെ വെളിച്ചത്തിൽ, മെൻഡലീവിൻ്റെ എല്ലാ മൂലകങ്ങളെയും ഏഴ് കാലഘട്ടങ്ങളായി വിഭജിക്കുന്നത് ന്യായീകരിക്കപ്പെടുന്നു: കാലഘട്ടത്തിൻ്റെ എണ്ണം ഇലക്ട്രോണുകൾ നിറഞ്ഞ ആറ്റങ്ങളുടെ ഊർജ്ജ നിലകളുടെ എണ്ണവുമായി പൊരുത്തപ്പെടുന്നു. ചെറിയ കാലഘട്ടങ്ങളിൽ, ആറ്റോമിക് ന്യൂക്ലിയസുകളുടെ പോസിറ്റീവ് ചാർജിൻ്റെ വർദ്ധനവോടെ, ബാഹ്യ തലത്തിലുള്ള ഇലക്ട്രോണുകളുടെ എണ്ണം വർദ്ധിക്കുന്നു (ആദ്യ കാലഘട്ടത്തിൽ 1 മുതൽ 2 വരെയും രണ്ടാമത്തെയും മൂന്നാമത്തെയും കാലഘട്ടങ്ങളിൽ 1 മുതൽ 8 വരെയും), ഇത് വിശദീകരിക്കുന്നു. മൂലകങ്ങളുടെ ഗുണങ്ങളിൽ മാറ്റം: കാലഘട്ടത്തിൻ്റെ തുടക്കത്തിൽ (ആദ്യത്തേത് ഒഴികെ) ആൽക്കലി ലോഹമുണ്ട്, തുടർന്ന് മെറ്റാലിക് ഗുണങ്ങളുടെ ക്രമാനുഗതമായ ദുർബലതയും ലോഹേതര ഗുണങ്ങളുടെ ശക്തിപ്പെടുത്തലും നിരീക്ഷിക്കപ്പെടുന്നു. രണ്ടാം കാലഘട്ടത്തിലെ ഘടകങ്ങൾക്ക് ഈ പാറ്റേൺ കണ്ടെത്താനാകും പട്ടിക 4.2.
പട്ടിക 4.2.

വലിയ കാലഘട്ടങ്ങളിൽ, ന്യൂക്ലിയസുകളുടെ ചാർജ് വർദ്ധിക്കുന്നതിനാൽ, ഇലക്ട്രോണുകൾ ഉപയോഗിച്ച് ലെവലുകൾ പൂരിപ്പിക്കുന്നത് കൂടുതൽ ബുദ്ധിമുട്ടാണ്, ഇത് ചെറിയ കാലഘട്ടങ്ങളിലെ മൂലകങ്ങളുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ മൂലകങ്ങളുടെ ഗുണങ്ങളിൽ കൂടുതൽ സങ്കീർണ്ണമായ മാറ്റം വിശദീകരിക്കുന്നു.
ഉപഗ്രൂപ്പുകളിലെ രാസ മൂലകങ്ങളുടെ ഗുണങ്ങളുടെ സമാന സ്വഭാവം ബാഹ്യ ഊർജ്ജ നിലയുടെ സമാന ഘടനയാൽ വിശദീകരിക്കപ്പെടുന്നു. മേശ 4.3, ആൽക്കലി ലോഹങ്ങളുടെ ഉപഗ്രൂപ്പുകൾക്കായി ഇലക്ട്രോണുകൾ ഉപയോഗിച്ച് ഊർജ്ജ നിലകൾ നിറയ്ക്കുന്നതിൻ്റെ ക്രമം ചിത്രീകരിക്കുന്നു.
പട്ടിക 4.3.

കെമിക്കൽ ബോണ്ടുകളുടെ രൂപീകരണത്തിൽ പങ്കെടുക്കാൻ കഴിയുന്ന ഒരു ആറ്റത്തിലെ ഇലക്ട്രോണുകളുടെ എണ്ണം സാധാരണയായി ഗ്രൂപ്പ് നമ്പർ സൂചിപ്പിക്കുന്നു. ഇതാണ് ഗ്രൂപ്പ് നമ്പറിൻ്റെ ഭൗതിക അർത്ഥം. ആവർത്തനപ്പട്ടികയുടെ നാല് സ്ഥലങ്ങളിൽ, ആറ്റോമിക പിണ്ഡം വർദ്ധിപ്പിക്കുന്ന ക്രമത്തിൽ മൂലകങ്ങൾ ക്രമീകരിച്ചിട്ടില്ല: Arഒപ്പം കെ,കോഒപ്പം നി,ടിഇഒപ്പം ഐ,ടിഒപ്പം പാ. ഈ വ്യതിയാനങ്ങൾ രാസ മൂലകങ്ങളുടെ ആവർത്തനപ്പട്ടികയുടെ പോരായ്മകളായി കണക്കാക്കപ്പെട്ടു. ആറ്റത്തിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള സിദ്ധാന്തം ഈ വ്യതിയാനങ്ങളെ വിശദീകരിച്ചു. ന്യൂക്ലിയർ ചാർജുകളുടെ പരീക്ഷണാത്മക നിർണ്ണയം ഈ മൂലകങ്ങളുടെ ക്രമീകരണം അവയുടെ ന്യൂക്ലിയസുകളുടെ ചാർജുകളുടെ വർദ്ധനവിന് തുല്യമാണെന്ന് കാണിച്ചു. കൂടാതെ, ആറ്റോമിക് ന്യൂക്ലിയസുകളുടെ ചാർജുകളുടെ പരീക്ഷണാത്മക നിർണ്ണയം ഹൈഡ്രജനും യുറേനിയവും തമ്മിലുള്ള മൂലകങ്ങളുടെ എണ്ണവും ലാന്തനൈഡുകളുടെ എണ്ണവും നിർണ്ണയിക്കുന്നത് സാധ്യമാക്കി. ഇപ്പോൾ ആവർത്തനപ്പട്ടികയിലെ എല്ലാ സ്ഥലങ്ങളും ഇടവേളയിൽ നിറഞ്ഞിരിക്കുന്നു Z=1മുമ്പ് Z=114എന്നിരുന്നാലും, ആനുകാലിക സംവിധാനം പൂർത്തിയായിട്ടില്ല, പുതിയ ട്രാൻസ്യുറേനിയം മൂലകങ്ങളുടെ കണ്ടെത്തൽ സാധ്യമാണ്.
ഒരു ആറ്റം നിർമ്മിക്കുന്നത് എങ്ങനെയെന്ന് നോക്കാം. ഞങ്ങൾ മോഡലുകളെക്കുറിച്ച് പ്രത്യേകമായി സംസാരിക്കുമെന്ന് ഓർമ്മിക്കുക. പ്രായോഗികമായി, ആറ്റങ്ങൾ കൂടുതൽ സങ്കീർണ്ണമായ ഘടനയാണ്. എന്നാൽ ആധുനിക സംഭവവികാസങ്ങൾക്ക് നന്ദി, പ്രോപ്പർട്ടികൾ (എല്ലാം അല്ലെങ്കിലും) വിശദീകരിക്കാനും വിജയകരമായി പ്രവചിക്കാനും ഞങ്ങൾക്ക് കഴിയും. അപ്പോൾ ഒരു ആറ്റത്തിൻ്റെ ഘടന എന്താണ്? ഇത് "ഉണ്ടാക്കിയത്" എന്താണ്?
ആറ്റത്തിൻ്റെ ഗ്രഹ മാതൃക
1913-ൽ ഡാനിഷ് ഭൗതികശാസ്ത്രജ്ഞനായ എൻ.ബോർ ആണ് ഇത് ആദ്യമായി നിർദ്ദേശിച്ചത്. ശാസ്ത്രീയ വസ്തുതകളെ അടിസ്ഥാനമാക്കിയുള്ള ആറ്റോമിക് ഘടനയുടെ ആദ്യ സിദ്ധാന്തമാണിത്. കൂടാതെ, ആധുനിക തീമാറ്റിക് ടെർമിനോളജിക്ക് ഇത് അടിത്തറയിട്ടു. അതിൽ, ഇലക്ട്രോണുകൾ-കണികകൾ സൂര്യനു ചുറ്റുമുള്ള ഗ്രഹങ്ങളുടെ അതേ തത്വമനുസരിച്ച് ആറ്റത്തിന് ചുറ്റും ഭ്രമണ ചലനങ്ങൾ ഉണ്ടാക്കുന്നു. ന്യൂക്ലിയസിൽ നിന്ന് കർശനമായി നിർവചിക്കപ്പെട്ട അകലത്തിൽ സ്ഥിതി ചെയ്യുന്ന ഭ്രമണപഥത്തിൽ മാത്രമായി അവ നിലനിൽക്കുമെന്ന് ബോർ നിർദ്ദേശിച്ചു. ശാസ്ത്രീയ വീക്ഷണകോണിൽ നിന്ന് ഇത് എന്തുകൊണ്ടാണെന്ന് വിശദീകരിക്കാൻ ശാസ്ത്രജ്ഞന് കഴിഞ്ഞില്ല, എന്നാൽ അത്തരമൊരു മാതൃക പല പരീക്ഷണങ്ങളിലൂടെയും സ്ഥിരീകരിച്ചു. ന്യൂക്ലിയസിനോട് ഏറ്റവും അടുത്ത് അക്കമിട്ടിരിക്കുന്ന ഒന്നിൽ തുടങ്ങി പരിക്രമണപഥങ്ങളെ നിയോഗിക്കാൻ പൂർണ്ണസംഖ്യകൾ ഉപയോഗിച്ചു. ഈ ഭ്രമണപഥങ്ങളെയെല്ലാം ലെവലുകൾ എന്നും വിളിക്കുന്നു. ഹൈഡ്രജൻ ആറ്റത്തിന് ഒരു ലെവൽ മാത്രമേയുള്ളൂ, അതിൽ ഒരു ഇലക്ട്രോൺ കറങ്ങുന്നു. എന്നാൽ സങ്കീർണ്ണമായ ആറ്റങ്ങൾക്കും തലങ്ങളുണ്ട്. സമാനമായ ഊർജ്ജ സാധ്യതയുള്ള ഇലക്ട്രോണുകളെ സംയോജിപ്പിക്കുന്ന ഘടകങ്ങളായി അവ തിരിച്ചിരിക്കുന്നു. അതിനാൽ, രണ്ടാമത്തേതിന് ഇതിനകം രണ്ട് ഉപതലങ്ങളുണ്ട് - 2s, 2p. മൂന്നാമത്തേതിന് ഇതിനകം മൂന്ന് ഉണ്ട് - 3s, 3p, 3d. ഇത്യാദി. ആദ്യം, കാമ്പിനോട് ചേർന്നുള്ള ഉപതലങ്ങൾ "ജനസഞ്ചാരമുള്ളവയാണ്", തുടർന്ന് ദൂരെയുള്ളവയാണ്. അവയിൽ ഓരോന്നിനും ഒരു നിശ്ചിത എണ്ണം ഇലക്ട്രോണുകൾ മാത്രമേ ഉൾക്കൊള്ളാൻ കഴിയൂ. എന്നാൽ ഇത് അവസാനമല്ല. ഓരോ ഉപതലവും പരിക്രമണപഥങ്ങളായി തിരിച്ചിരിക്കുന്നു. നമുക്ക് സാധാരണ ജീവിതവുമായി താരതമ്യം ചെയ്യാം. ഒരു ആറ്റത്തിൻ്റെ ഇലക്ട്രോൺ മേഘം ഒരു നഗരവുമായി താരതമ്യപ്പെടുത്താവുന്നതാണ്. ലെവലുകൾ തെരുവുകളാണ്. സബ്ലെവൽ - സ്വകാര്യ വീട് അല്ലെങ്കിൽ അപ്പാർട്ട്മെൻ്റ്. പരിക്രമണം - മുറി. അവയിൽ ഓരോന്നും ഒന്നോ രണ്ടോ ഇലക്ട്രോണുകൾ "ജീവിക്കുന്നു". അവർക്കെല്ലാം പ്രത്യേക വിലാസങ്ങളുണ്ട്. ആറ്റത്തിൻ്റെ ഘടനയുടെ ആദ്യ ഡയഗ്രം ഇതായിരുന്നു. അവസാനമായി, ഇലക്ട്രോണുകളുടെ വിലാസങ്ങളെക്കുറിച്ച്: അവ നിർണ്ണയിക്കുന്നത് "ക്വാണ്ടം" എന്ന് വിളിക്കപ്പെടുന്ന സംഖ്യകളുടെ ഗണങ്ങളാണ്.
ആറ്റത്തിൻ്റെ തരംഗ മാതൃക

എന്നാൽ കാലക്രമേണ, ഗ്രഹ മാതൃക പരിഷ്കരിച്ചു. ആറ്റോമിക് ഘടനയുടെ രണ്ടാമത്തെ സിദ്ധാന്തം നിർദ്ദേശിക്കപ്പെട്ടു. ഇത് കൂടുതൽ വിപുലമായതും പ്രായോഗിക പരീക്ഷണങ്ങളുടെ ഫലങ്ങൾ വിശദീകരിക്കാൻ നിങ്ങളെ അനുവദിക്കുന്നു. ഇ. ഷ്രോഡിംഗർ നിർദ്ദേശിച്ച ആറ്റത്തിൻ്റെ തരംഗ മാതൃകയാണ് ആദ്യത്തേത് മാറ്റിസ്ഥാപിച്ചത്. ഒരു ഇലക്ട്രോണിന് ഒരു കണികയായി മാത്രമല്ല, ഒരു തരംഗമായും പ്രകടമാകുമെന്ന് ഇതിനകം തന്നെ സ്ഥാപിക്കപ്പെട്ടു. ഷ്രോഡിംഗർ എന്താണ് ചെയ്തത്? ഒരു തരംഗത്തിൻ്റെ ചലനത്തെ വിവരിക്കുന്ന ഒരു സമവാക്യം അദ്ദേഹം പ്രയോഗിച്ചു, അങ്ങനെ, ഒരാൾക്ക് ഒരു ആറ്റത്തിലെ ഇലക്ട്രോണിൻ്റെ പാതയല്ല, ഒരു നിശ്ചിത ഘട്ടത്തിൽ അത് കണ്ടെത്താനുള്ള സാധ്യത കണ്ടെത്താനാകും. രണ്ട് സിദ്ധാന്തങ്ങളെയും ഒന്നിപ്പിക്കുന്നത്, പ്രാഥമിക കണങ്ങൾ പ്രത്യേക തലങ്ങളിലും ഉപതലങ്ങളിലും പരിക്രമണപഥങ്ങളിലും സ്ഥിതി ചെയ്യുന്നു എന്നതാണ്. ഇവിടെയാണ് മോഡലുകൾ തമ്മിലുള്ള സാമ്യം അവസാനിക്കുന്നത്. ഞാൻ നിങ്ങൾക്ക് ഒരു ഉദാഹരണം നൽകാം: തരംഗ സിദ്ധാന്തത്തിൽ, 95% സാധ്യതയുള്ള ഒരു ഇലക്ട്രോൺ കണ്ടെത്താനാകുന്ന ഒരു മേഖലയാണ് പരിക്രമണം. ബാക്കിയുള്ള സ്ഥലങ്ങൾ 5% വരും.എന്നാൽ അവസാനം ആറ്റങ്ങളുടെ ഘടനാപരമായ സവിശേഷതകൾ വേവ് മോഡൽ ഉപയോഗിച്ചാണ് ചിത്രീകരിച്ചിരിക്കുന്നത്, ഉപയോഗിക്കുന്ന പദങ്ങൾ സാധാരണമാണെങ്കിലും.
ഈ കേസിൽ പ്രോബബിലിറ്റി എന്ന ആശയം

എന്തുകൊണ്ടാണ് ഈ പദം ഉപയോഗിച്ചത്? ഹൈസൻബെർഗ് 1927-ൽ അനിശ്ചിതത്വ തത്വം രൂപീകരിച്ചു, അത് ഇപ്പോൾ സൂക്ഷ്മകണങ്ങളുടെ ചലനത്തെ വിവരിക്കാൻ ഉപയോഗിക്കുന്നു. അത് സാധാരണ ഭൗതിക ശരീരങ്ങളിൽ നിന്നുള്ള അടിസ്ഥാന വ്യത്യാസത്തെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്. എന്താണിത്? ഒരു വ്യക്തിക്ക് പ്രതിഭാസങ്ങളെ സ്വാധീനിക്കാതെ നിരീക്ഷിക്കാൻ കഴിയുമെന്ന് ക്ലാസിക്കൽ മെക്കാനിക്സ് അനുമാനിച്ചു (ആകാശ വസ്തുക്കളുടെ നിരീക്ഷണം). ലഭിച്ച ഡാറ്റയെ അടിസ്ഥാനമാക്കി, ഒരു നിശ്ചിത സമയത്ത് വസ്തു എവിടെയാണെന്ന് കണക്കാക്കാൻ കഴിയും. എന്നാൽ മൈക്രോകോസത്തിൽ കാര്യങ്ങൾ വ്യത്യസ്തമാണ്. അതിനാൽ, ഉദാഹരണത്തിന്, ഉപകരണത്തിൻ്റെയും കണികയുടെയും ഊർജ്ജം താരതമ്യപ്പെടുത്താനാവാത്ത വസ്തുത കാരണം ഒരു ഇലക്ട്രോണിനെ സ്വാധീനിക്കാതെ നിരീക്ഷിക്കുന്നത് ഇപ്പോൾ സാധ്യമല്ല. ഇത് പ്രാഥമിക കണത്തിൻ്റെ സ്ഥാനം, അവസ്ഥ, ദിശ, ചലന വേഗത, മറ്റ് പാരാമീറ്ററുകൾ എന്നിവയിൽ മാറ്റങ്ങളിലേക്ക് നയിക്കുന്നു. കൃത്യമായ സ്വഭാവസവിശേഷതകളെക്കുറിച്ച് സംസാരിക്കുന്നതിൽ അർത്ഥമില്ല. ന്യൂക്ലിയസിന് ചുറ്റുമുള്ള ഇലക്ട്രോണിൻ്റെ കൃത്യമായ പാത കണക്കാക്കുന്നത് അസാധ്യമാണെന്ന് അനിശ്ചിതത്വ തത്വം തന്നെ പറയുന്നു. ഒരു നിശ്ചിത സ്ഥലത്ത് ഒരു കണിക കണ്ടെത്താനുള്ള സാധ്യത മാത്രമേ നിങ്ങൾക്ക് സൂചിപ്പിക്കാൻ കഴിയൂ. രാസ മൂലകങ്ങളുടെ ആറ്റങ്ങളുടെ ഘടനയുടെ പ്രത്യേകത ഇതാണ്. എന്നാൽ ഇത് പ്രായോഗിക പരീക്ഷണങ്ങളിൽ ശാസ്ത്രജ്ഞർ മാത്രം കണക്കിലെടുക്കണം.
ആറ്റോമിക് ഘടന
എന്നാൽ നമുക്ക് മുഴുവൻ വിഷയത്തിലും ശ്രദ്ധ കേന്ദ്രീകരിക്കാം. അതിനാൽ, നന്നായി പരിഗണിക്കപ്പെടുന്ന ഇലക്ട്രോൺ ഷെല്ലിന് പുറമേ, ആറ്റത്തിൻ്റെ രണ്ടാമത്തെ ഘടകം ന്യൂക്ലിയസ് ആണ്. പോസിറ്റീവ് ചാർജുള്ള പ്രോട്ടോണുകളും ന്യൂട്രൽ ന്യൂട്രോണുകളും ഇതിൽ അടങ്ങിയിരിക്കുന്നു. ആവർത്തനപ്പട്ടിക നമുക്കെല്ലാം സുപരിചിതമാണ്. ഓരോ മൂലകത്തിൻ്റെയും എണ്ണം അതിൽ അടങ്ങിയിരിക്കുന്ന പ്രോട്ടോണുകളുടെ എണ്ണവുമായി പൊരുത്തപ്പെടുന്നു. ന്യൂട്രോണുകളുടെ എണ്ണം ഒരു ആറ്റത്തിൻ്റെ പിണ്ഡവും പ്രോട്ടോണുകളുടെ എണ്ണവും തമ്മിലുള്ള വ്യത്യാസത്തിന് തുല്യമാണ്. ഈ നിയമത്തിൽ നിന്ന് വ്യതിയാനങ്ങൾ ഉണ്ടാകാം. അപ്പോൾ മൂലകത്തിൻ്റെ ഒരു ഐസോടോപ്പ് ഉണ്ടെന്ന് അവർ പറയുന്നു. ഒരു ആറ്റത്തിൻ്റെ ഘടന ഒരു ഇലക്ട്രോൺ ഷെൽ കൊണ്ട് "ചുറ്റും" ആണ്. സാധാരണയായി പ്രോട്ടോണുകളുടെ എണ്ണത്തിന് തുല്യമാണ്. രണ്ടാമത്തേതിൻ്റെ പിണ്ഡം മുമ്പത്തേതിനേക്കാൾ ഏകദേശം 1840 മടങ്ങ് കൂടുതലാണ്, ഇത് ന്യൂട്രോണിൻ്റെ ഭാരത്തിന് ഏകദേശം തുല്യമാണ്. ന്യൂക്ലിയസിൻ്റെ ആരം ആറ്റത്തിൻ്റെ വ്യാസത്തിൻ്റെ 1/200,000 ആണ്. അതിന് തന്നെ ഒരു ഗോളാകൃതിയുണ്ട്. ഇത് പൊതുവേ, രാസ മൂലകങ്ങളുടെ ആറ്റങ്ങളുടെ ഘടനയാണ്. പിണ്ഡത്തിലും ഗുണങ്ങളിലും വ്യത്യാസമുണ്ടെങ്കിലും, അവ ഏകദേശം ഒരുപോലെയാണ്.
ഭ്രമണപഥങ്ങൾ

ഒരു ആറ്റോമിക് സ്ട്രക്ചർ ഡയഗ്രം എന്താണെന്നതിനെക്കുറിച്ച് സംസാരിക്കുമ്പോൾ, അവയെക്കുറിച്ച് നിശബ്ദത പാലിക്കാൻ കഴിയില്ല. അതിനാൽ, ഈ തരങ്ങളുണ്ട്:
- എസ്. അവയ്ക്ക് ഗോളാകൃതിയുണ്ട്.
- പി. അവ ത്രിമാന ഫിഗർ എട്ട് അല്ലെങ്കിൽ ഒരു സ്പിൻഡിൽ പോലെ കാണപ്പെടുന്നു.
- ഡി, എഫ്. ഔപചാരിക ഭാഷയിൽ വിവരിക്കാൻ പ്രയാസമുള്ള സങ്കീർണ്ണമായ ആകൃതിയാണ് അവയ്ക്കുള്ളത്.
ഓരോ തരത്തിലുമുള്ള ഒരു ഇലക്ട്രോണിനെ അനുബന്ധ പരിക്രമണപഥത്തിൽ 95% സംഭാവ്യതയോടെ കണ്ടെത്താനാകും. അവതരിപ്പിച്ച വിവരങ്ങൾ ശാന്തമായി പരിഗണിക്കണം, കാരണം ഇത് ഭൗതിക യാഥാർത്ഥ്യത്തേക്കാൾ അമൂർത്തമായ ഗണിതശാസ്ത്ര മാതൃകയാണ്. എന്നാൽ ഇതിനെല്ലാം പുറമേ, ആറ്റങ്ങളുടെയും തന്മാത്രകളുടെയും രാസ ഗുണങ്ങളെക്കുറിച്ച് ഇതിന് നല്ല പ്രവചന ശക്തിയുണ്ട്. ന്യൂക്ലിയസിൽ നിന്ന് കൂടുതൽ ഒരു ലെവൽ സ്ഥിതി ചെയ്യുന്നു, അതിൽ കൂടുതൽ ഇലക്ട്രോണുകൾ സ്ഥാപിക്കാൻ കഴിയും. അതിനാൽ, ഒരു പ്രത്യേക ഫോർമുല ഉപയോഗിച്ച് പരിക്രമണപഥങ്ങളുടെ എണ്ണം കണക്കാക്കാം: x 2. ഇവിടെ x എന്നത് ലെവലുകളുടെ എണ്ണത്തിന് തുല്യമാണ്. ഒരു പരിക്രമണപഥത്തിൽ രണ്ട് ഇലക്ട്രോണുകൾ വരെ സ്ഥാപിക്കാൻ കഴിയുമെന്നതിനാൽ, ആത്യന്തികമായി അവയുടെ സംഖ്യാ തിരയലിനുള്ള ഫോർമുല ഇതുപോലെയായിരിക്കും: 2x 2.
ഭ്രമണപഥങ്ങൾ: സാങ്കേതിക ഡാറ്റ

ഫ്ലൂറിൻ ആറ്റത്തിൻ്റെ ഘടനയെക്കുറിച്ച് നമ്മൾ സംസാരിക്കുകയാണെങ്കിൽ, അതിന് മൂന്ന് പരിക്രമണപഥങ്ങൾ ഉണ്ടാകും. അവയെല്ലാം നിറയും. ഒരു ഉപതലത്തിലുള്ള പരിക്രമണപഥങ്ങളുടെ ഊർജ്ജം ഒന്നുതന്നെയാണ്. അവയെ നിയോഗിക്കുന്നതിന്, ലെയർ നമ്പർ ചേർക്കുക: 2s, 4p, 6d. ഫ്ലൂറിൻ ആറ്റത്തിൻ്റെ ഘടനയെക്കുറിച്ചുള്ള സംഭാഷണത്തിലേക്ക് മടങ്ങാം. ഇതിന് രണ്ട് എസ്-ഉം ഒരു പി-സബ്ലെവലും ഉണ്ടായിരിക്കും. ഇതിന് ഒമ്പത് പ്രോട്ടോണുകളും അത്രതന്നെ ഇലക്ട്രോണുകളും ഉണ്ട്. ആദ്യത്തേത് എസ്-ലെവൽ. അത് രണ്ട് ഇലക്ട്രോണുകളാണ്. പിന്നെ രണ്ടാമത്തെ എസ്-ലെവൽ. രണ്ട് ഇലക്ട്രോണുകൾ കൂടി. കൂടാതെ 5 p-ലെവൽ പൂരിപ്പിക്കുന്നു. ഇതാണ് അവൻ്റെ ഘടന. ഇനിപ്പറയുന്ന ഉപശീർഷകം വായിച്ചതിനുശേഷം, നിങ്ങൾക്ക് ആവശ്യമായ നടപടികൾ സ്വയം ചെയ്യാനും ഇത് ഉറപ്പാക്കാനും കഴിയും. ഏത് ഫ്ലൂറിനും ഉൾപ്പെടുന്നു എന്നതിനെക്കുറിച്ച് നമ്മൾ സംസാരിക്കുകയാണെങ്കിൽ, അവ ഒരേ ഗ്രൂപ്പിലാണെങ്കിലും അവയുടെ സ്വഭാവങ്ങളിൽ തികച്ചും വ്യത്യസ്തമാണ് എന്നത് ശ്രദ്ധിക്കേണ്ടതാണ്. അങ്ങനെ, അവയുടെ തിളനില -188 മുതൽ 309 ഡിഗ്രി സെൽഷ്യസ് വരെയാണ്. പിന്നെ എന്തിനാണ് അവർ ഒന്നിച്ചത്? എല്ലാം രാസ ഗുണങ്ങൾക്ക് നന്ദി. എല്ലാ ഹാലോജനുകൾക്കും ഫ്ലൂറിനും പരമാവധി ഓക്സിഡൈസിംഗ് കഴിവുണ്ട്. അവ ലോഹങ്ങളുമായി പ്രതിപ്രവർത്തിക്കുകയും മുറിയിലെ താപനിലയിൽ ഒരു പ്രശ്നവുമില്ലാതെ സ്വയമേവ കത്തിക്കുകയും ചെയ്യും.
എങ്ങനെയാണ് ഭ്രമണപഥങ്ങൾ നിറയുന്നത്?
ഇലക്ട്രോണുകൾ ഏത് നിയമങ്ങളും തത്വങ്ങളും അനുസരിച്ചാണ് ക്രമീകരിച്ചിരിക്കുന്നത്? മൂന്ന് പ്രധാനവയുമായി നിങ്ങൾ സ്വയം പരിചയപ്പെടാൻ ഞങ്ങൾ നിർദ്ദേശിക്കുന്നു, മികച്ച ധാരണയ്ക്കായി ഇവയുടെ വാക്കുകൾ ലളിതമാക്കിയിരിക്കുന്നു:
- കുറഞ്ഞ ഊർജ്ജത്തിൻ്റെ തത്വം. ഊർജ്ജം വർദ്ധിപ്പിക്കുന്ന ക്രമത്തിൽ ഇലക്ട്രോണുകൾ പരിക്രമണപഥങ്ങളെ നിറയ്ക്കുന്നു.
- പോളിയുടെ തത്വം. ഒരു പരിക്രമണപഥത്തിൽ രണ്ടിൽ കൂടുതൽ ഇലക്ട്രോണുകൾ അടങ്ങിയിരിക്കരുത്.
- ഹണ്ടിൻ്റെ ഭരണം. ഒരു ഉപതലത്തിൽ, ഇലക്ട്രോണുകൾ ആദ്യം ശൂന്യമായ പരിക്രമണപഥങ്ങൾ നിറയ്ക്കുന്നു, അതിനുശേഷം മാത്രമേ ജോഡികൾ ഉണ്ടാകൂ.
ആറ്റത്തിൻ്റെ ഘടന അത് പൂരിപ്പിക്കുന്നതിന് സഹായിക്കും, ഈ സാഹചര്യത്തിൽ അത് ഇമേജിൻ്റെ കാര്യത്തിൽ കൂടുതൽ മനസ്സിലാക്കാവുന്നതേയുള്ളൂ. അതിനാൽ, സർക്യൂട്ട് ഡയഗ്രമുകളുടെ നിർമ്മാണവുമായി പ്രായോഗികമായി പ്രവർത്തിക്കുമ്പോൾ, അത് കൈയിൽ സൂക്ഷിക്കേണ്ടത് ആവശ്യമാണ്.
ഉദാഹരണം

ലേഖനത്തിൻ്റെ ചട്ടക്കൂടിനുള്ളിൽ പറഞ്ഞിരിക്കുന്നതെല്ലാം സംഗ്രഹിക്കുന്നതിന്, ഒരു ആറ്റത്തിൻ്റെ ഇലക്ട്രോണുകൾ അവയുടെ ലെവലുകൾ, സബ്ലെവലുകൾ, ഓർബിറ്റലുകൾ (അതായത്, ലെവലുകളുടെ കോൺഫിഗറേഷൻ എന്താണ്) എന്നിവയിൽ എങ്ങനെ വിതരണം ചെയ്യപ്പെടുന്നു എന്നതിൻ്റെ ഒരു സാമ്പിൾ നിങ്ങൾക്ക് വരയ്ക്കാം. ഇത് ഒരു ഫോർമുലയായോ ഊർജ്ജ രേഖാചിത്രമായോ ലെയർ ഡയഗ്രമായോ ചിത്രീകരിക്കാം. വളരെ നല്ല ചിത്രീകരണങ്ങൾ ഇവിടെയുണ്ട്, അവ സൂക്ഷ്മപരിശോധനയിൽ ആറ്റത്തിൻ്റെ ഘടന മനസ്സിലാക്കാൻ സഹായിക്കുന്നു. അതിനാൽ, ആദ്യ ലെവൽ ആദ്യം പൂരിപ്പിക്കുന്നു. ഇതിന് ഒരു ഉപതലം മാത്രമേയുള്ളൂ, അതിൽ ഒരു പരിക്രമണം മാത്രമേയുള്ളൂ. എല്ലാ ലെവലുകളും തുടർച്ചയായി പൂരിപ്പിച്ചിരിക്കുന്നു, ചെറിയതിൽ നിന്ന് ആരംഭിക്കുന്നു. ആദ്യം, ഒരു ഉപതലത്തിൽ, ഓരോ പരിക്രമണപഥത്തിലും ഒരു ഇലക്ട്രോൺ സ്ഥാപിക്കുന്നു. തുടർന്ന് ജോഡികൾ സൃഷ്ടിക്കപ്പെടുന്നു. സ്വതന്ത്രമായവ ഉണ്ടെങ്കിൽ, മറ്റൊരു പൂരിപ്പിക്കൽ വിഷയത്തിലേക്ക് ഒരു സ്വിച്ച് സംഭവിക്കുന്നു. നൈട്രജൻ അല്ലെങ്കിൽ ഫ്ലൂറിൻ ആറ്റത്തിൻ്റെ ഘടന എന്താണെന്ന് ഇപ്പോൾ നിങ്ങൾക്ക് സ്വയം കണ്ടെത്താനാകും (ഇത് നേരത്തെ പരിഗണിച്ചിരുന്നു). ആദ്യം ഇത് അൽപ്പം ബുദ്ധിമുട്ടായിരിക്കാം, പക്ഷേ നിങ്ങളെ നയിക്കാൻ നിങ്ങൾക്ക് ചിത്രങ്ങൾ ഉപയോഗിക്കാം. വ്യക്തതയ്ക്കായി, നൈട്രജൻ ആറ്റത്തിൻ്റെ ഘടന നോക്കാം. ഇതിന് 7 പ്രോട്ടോണുകളും (ന്യൂക്ലിയസ് നിർമ്മിക്കുന്ന ന്യൂട്രോണുകളോടൊപ്പം) അതേ എണ്ണം ഇലക്ട്രോണുകളും (ഇലക്ട്രോൺ ഷെൽ ഉണ്ടാക്കുന്നവ) ഉണ്ട്. ആദ്യ എസ്-ലെവൽ ആദ്യം പൂരിപ്പിക്കുന്നു. ഇതിന് 2 ഇലക്ട്രോണുകൾ ഉണ്ട്. അപ്പോൾ രണ്ടാമത്തെ s-ലെവൽ വരുന്നു. ഇതിന് 2 ഇലക്ട്രോണുകളും ഉണ്ട്. മറ്റ് മൂന്നെണ്ണം പി-ലെവലിൽ സ്ഥാപിച്ചിരിക്കുന്നു, അവിടെ ഓരോന്നും ഓരോ പരിക്രമണപഥം ഉൾക്കൊള്ളുന്നു.
ഉപസംഹാരം

നിങ്ങൾക്ക് കാണാനാകുന്നതുപോലെ, ആറ്റത്തിൻ്റെ ഘടന അത്ര ബുദ്ധിമുട്ടുള്ള വിഷയമല്ല (നിങ്ങൾ ഒരു സ്കൂൾ കെമിസ്ട്രി കോഴ്സിൻ്റെ വീക്ഷണകോണിൽ നിന്ന് സമീപിക്കുകയാണെങ്കിൽ, തീർച്ചയായും). കൂടാതെ ഈ വിഷയം മനസ്സിലാക്കുന്നത് ബുദ്ധിമുട്ടുള്ള കാര്യമല്ല. അവസാനമായി, ചില സവിശേഷതകളെക്കുറിച്ച് ഞാൻ നിങ്ങളോട് പറയാൻ ആഗ്രഹിക്കുന്നു. ഉദാഹരണത്തിന്, ഓക്സിജൻ ആറ്റത്തിൻ്റെ ഘടനയെക്കുറിച്ച് പറയുമ്പോൾ, അതിൽ എട്ട് പ്രോട്ടോണുകളും 8-10 ന്യൂട്രോണുകളും ഉണ്ടെന്ന് നമുക്കറിയാം. പ്രകൃതിയിലെ എല്ലാം സന്തുലിതമാകുന്നതിനാൽ, രണ്ട് ഓക്സിജൻ ആറ്റങ്ങൾ ഒരു തന്മാത്രയായി മാറുന്നു, അവിടെ ജോടിയാക്കാത്ത രണ്ട് ഇലക്ട്രോണുകൾ ഒരു കോവാലൻ്റ് ബോണ്ട് ഉണ്ടാക്കുന്നു. മറ്റൊരു സ്ഥിരതയുള്ള ഓക്സിജൻ തന്മാത്രയായ ഓസോൺ (O3) സമാനമായ രീതിയിൽ രൂപം കൊള്ളുന്നു. ഓക്സിജൻ ആറ്റത്തിൻ്റെ ഘടന അറിയുന്നതിലൂടെ, ഭൂമിയിലെ ഏറ്റവും സാധാരണമായ പദാർത്ഥം പങ്കെടുക്കുന്ന ഓക്സിഡേറ്റീവ് പ്രതിപ്രവർത്തനങ്ങളുടെ സൂത്രവാക്യങ്ങൾ നിങ്ങൾക്ക് ശരിയായി വരയ്ക്കാം.