Virimas. Savitoji garavimo ir kondensacijos šiluma. Kokia yra savitoji garavimo šiluma ir kaip ją nustatyti
Šioje pamokoje atkreipsime dėmesį į šį garinimo būdą, pavyzdžiui, virimą, aptarsime jo skirtumus nuo anksčiau aptarto garinimo proceso, pristatysime tokią reikšmę kaip virimo temperatūra ir aptarsime, nuo ko ji priklauso. Pamokos pabaigoje supažindinsime su labai svarbiu garavimo procesą apibūdinančiu dydžiu – specifine garavimo ir kondensacijos šiluma.
Tema: agreguotos medžiagos būsenos
Pamoka: Virimas. Specifinė šiluma garavimas ir kondensacija
Paskutinėje pamokoje jau apžvelgėme vieną iš garų susidarymo rūšių – garavimą – ir pabrėžėme šio proceso savybes. Šiandien aptarsime šį garinimo tipą, virimo procesą ir pristatysime vertę, kuri skaitiniu būdu apibūdina garinimo procesą – savitąją garavimo ir kondensacijos šilumą.
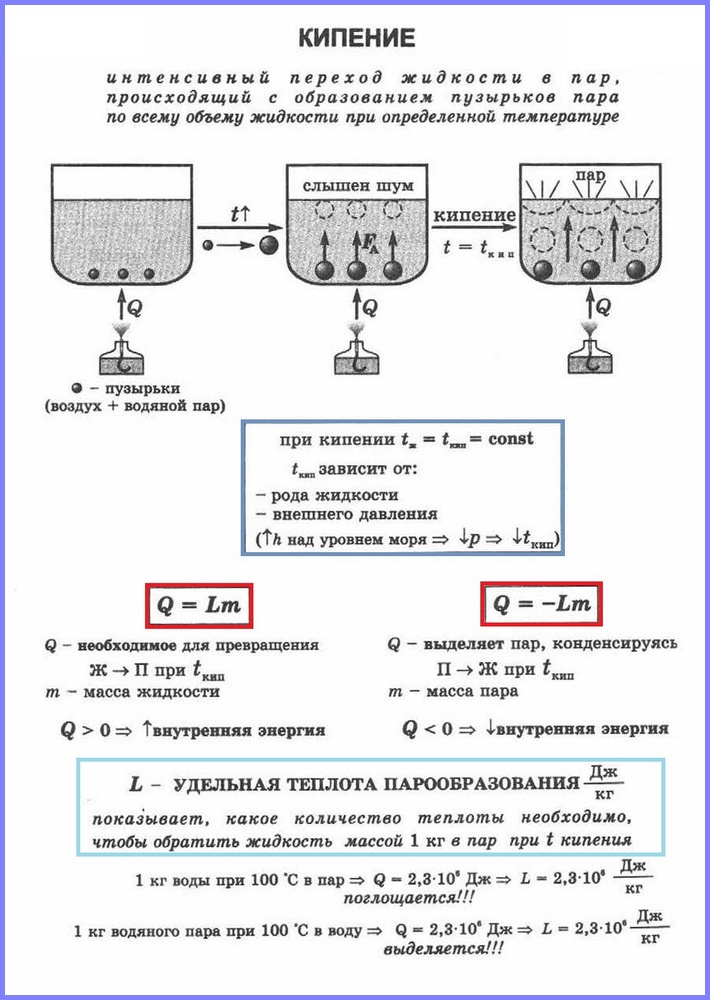
Apibrėžimas.Virimas(1 pav.) – tai intensyvaus skysčio perėjimo į dujinę būseną procesas, lydimas garų burbuliukų susidarymo ir vykstantis visame skysčio tūryje tam tikroje temperatūroje, kuri vadinama virimo temperatūra.
Palyginkime du garinimo tipus tarpusavyje. Virimo procesas yra intensyvesnis nei garinimo procesas. Be to, kaip prisimename, garavimo procesas vyksta bet kurioje temperatūroje, viršijančioje lydymosi tašką, o virimo procesas griežtai tam tikroje temperatūroje, kuri kiekvienai medžiagai skiriasi ir vadinama virimo temperatūra. Taip pat reikia pažymėti, kad išgaravimas vyksta tik su laisvas paviršius skystis, t.y. iš ploto, ribojančio jį nuo aplinkinių dujų, o verdant – iš viso tūrio iš karto.
Pažvelkime atidžiau į virimo procesą. Įsivaizduokime situaciją, su kuria daugelis iš mūsų ne kartą yra susidūrę – vandens kaitinimą ir verdymą tam tikrame inde, pavyzdžiui, puode. Šildymo metu tam tikras šilumos kiekis bus perduotas vandeniui, todėl padidės jo vidinė energija ir padidės molekulinio judėjimo aktyvumas. Šis procesas tęsis iki tam tikro etapo, kol molekulinio judėjimo energijos pakaks virti.
Vandenyje yra ištirpusių dujų (ar kitų priemaišų), kurios išsiskiria jo struktūroje, todėl susidaro vadinamieji garavimo centrai. Tai yra, būtent šiuose centruose pradeda išsiskirti garai, o visame vandens tūryje susidaro burbuliukai, kurie stebimi verdant. Svarbu suprasti, kad šiuose burbuluose yra ne oras, o garai, kurie susidaro virimo metu. Susidarius burbuliukams, garų kiekis juose didėja, jie pradeda didėti. Dažnai burbuliukai iš pradžių susidaro šalia indo sienelių ir iš karto nepakyla į paviršių; pirmiausia, didėjant dydžiui, jie yra veikiami didėjančios Archimedo jėgos, o paskui atitrūksta nuo sienos ir iškyla į paviršių, kur sprogsta ir išleidžia dalį garų.
Verta paminėti, kad ne visi garų burbuliukai iš karto pasiekia laisvą vandens paviršių. Virimo proceso pradžioje vanduo dar neįkaista tolygiai ir apatiniai sluoksniai, šalia kurių tiesiogiai vyksta šilumos perdavimo procesas, net ir atsižvelgiant į konvekcinį procesą, yra dar karštesni nei viršutiniai. Tai lemia tai, kad iš apačios kylantys garų burbuliukai subyra dėl paviršiaus įtempimo reiškinio, nepasiekę laisvo vandens paviršiaus. Tokiu atveju garai, buvę burbuliukų viduje, patenka į vandenį, taip dar labiau jį kaitindami ir paspartindami vienodo vandens kaitinimo visame tūryje procesą. Dėl to, vandeniui įšylant beveik tolygiai, beveik visi garų burbuliukai pradeda pasiekti vandens paviršių ir prasideda intensyvaus garų susidarymo procesas.
Svarbu pabrėžti, kad temperatūra, kurioje vyksta virimo procesas, išlieka nepakitusi net padidinus šilumos tiekimo skysčiui intensyvumą. Paprastais žodžiais, jei virimo metu įpilsite dujų į degiklį, kaitinantį vandens puodą, tai tik padidins virimo intensyvumą, o ne padidins skysčio temperatūrą. Jei rimčiau įsigilintume į virimo procesą, verta pastebėti, kad vandenyje atsiranda vietų, kuriose jis gali perkaisti virš virimo temperatūros, tačiau tokio perkaitimo kiekis, kaip taisyklė, neviršija vieno ar poros laipsnių. ir yra nereikšmingas bendrame skysčio tūryje. Vandens virimo temperatūra esant normaliam slėgiui yra 100 ° C.
Verdant vandenį galite pastebėti, kad jį lydi būdingi vadinamojo virtimo garsai. Šie garsai kyla būtent dėl aprašyto garų burbuliukų subyrėjimo proceso.
Kitų skysčių virimo procesai vyksta taip pat, kaip ir vandens virimas. Pagrindinis šių procesų skirtumas yra skirtingos medžiagų virimo temperatūros, kurios esant normaliam atmosferos slėgiui jau yra išmatuotos lentelės reikšmės. Lentelėje nurodome pagrindines šių temperatūrų vertes.
Įdomus faktas yra tai, kad skysčių virimo temperatūra priklauso nuo atmosferos slėgio vertės, todėl nurodėme, kad visos lentelėje pateiktos vertės pateiktos esant normaliam atmosferos slėgiui. Didėjant oro slėgiui, didėja ir skysčio virimo temperatūra, o mažėjant – priešingai – mažėja.
Dėl šios virimo temperatūros priklausomybės nuo slėgio aplinką remiantis tokio gerai žinomo virtuvės prietaiso kaip greitpuodis veikimo principu (2 pav.). Tai keptuvė su sandariai užsidengiančiu dangčiu, po kuria vandens garinimo proceso metu oro slėgis su garais siekia iki 2 atmosferos slėgio, dėl to vandens virimo temperatūra joje pakyla iki . Dėl šios priežasties vanduo ir jame esantis maistas turi galimybę įkaisti iki aukštesnės nei įprastai temperatūros (), o gaminimo procesas paspartėja. Dėl šio efekto įrenginys gavo savo pavadinimą.

Ryžiai. 2. Greitpuodis ()
Situacija, kai sumažėjusi skysčio virimo temperatūra sumažėjus atmosferos slėgiui, taip pat turi pavyzdį iš gyvenimo, tačiau daugeliui žmonių jau nebe kasdien. Šis pavyzdys tinka alpinistų kelionėms aukštų kalnų regionuose. Pasirodo, vietovėse, esančiose 3000–5000 m aukštyje, vandens virimo temperatūra dėl atmosferos slėgio sumažėjimo sumažėja iki žemesnių verčių, o tai sukelia sunkumų ruošiant maistą žygiuose, nes karščio gydymas produktai šiuo atveju reikalauja žymiai daugiau laiko nei tada normaliomis sąlygomis. Maždaug 7000 m aukštyje vandens virimo temperatūra pasiekia , todėl daugelio produktų tokiomis sąlygomis virti neįmanoma.
Apie tai, kad virimo temperatūros įvairių medžiagų skiriasi, yra pagrįstos kai kurios medžiagų atskyrimo technologijos. Pavyzdžiui, jei atsižvelgsime į šildymo alyvą, kuri yra sudėtingas skystis, susidedantis iš daugelio komponentų, tada virimo metu jis gali būti suskirstytas į keletą skirtingų medžiagų. IN tokiu atveju, dėl to, kad žibalo, benzino, benzino ir mazuto virimo temperatūra skiriasi, jie gali būti atskirti vienas nuo kito garuojant ir kondensuojantis esant skirtingoms temperatūroms. Šis procesas paprastai vadinamas frakcionavimu (3 pav.).

Ryžiai. 3 Aliejaus padalijimas į frakcijas ()
Kaip ir bet kas fizinis procesas, virimas turi būti apibūdintas naudojant kokią nors skaitinę reikšmę, tokia reikšmė vadinama specifine garavimo šiluma.
Norėdami suprasti fizinę šios vertės reikšmę, apsvarstykite šį pavyzdį: paimkite 1 kg vandens ir užvirkite, tada išmatuokite, kiek šilumos reikia, kad šis vanduo visiškai išgaruotų (neatsižvelgiant į šilumos nuostolius) - ši vertė bus lygi savitajai vandens garavimo šilumai. Kitai medžiagai ši šiluminė vertė bus kitokia ir bus specifinė šios medžiagos garavimo šiluma.
Specifinė garavimo šiluma pasirodo labai svarbi savybėšiuolaikinėse metalo gamybos technologijose. Pasirodo, kad, pavyzdžiui, kai geležis tirpsta ir išgaruoja, o vėliau kondensuojasi ir kietėja, kristalinė ląstelė su konstrukcija, kuri užtikrina didesnį stiprumą nei pradinis pavyzdys.
Paskyrimas: savitoji garavimo ir kondensacijos šiluma (kartais žymima ).
Vienetas: .
Specifinė medžiagų garavimo šiluma nustatoma laboratoriniais eksperimentais, o pagrindinių medžiagų jos reikšmės nurodytos atitinkamoje lentelėje.
|
Medžiaga |
Visi žino, kad vanduo virdulyje užverda 100˚C temperatūroje. Bet ar pastebėjote, kad virimo metu vandens temperatūra nekinta? Kyla klausimas – kur dingsta pagaminta energija, jei nuolat degame indą? Jis paverčia skystį garais. Taigi, kad vanduo virstų dujine būsena, reikalingas nuolatinis šilumos tiekimas. Kiek jo reikia kilogramui skysčio paversti tokios pat temperatūros garais, nustatoma pagal fizikinį dydį, vadinamą specifine vandens garavimo šiluma.
Fizinė kiekio reikšmė
Virimui reikia energijos. Didžioji jo dalis naudojama cheminiams ryšiams tarp atomų ir molekulių nutraukti, dėl to susidaro garų burbuliukai, o mažesnė dalis naudojama garams plėsti, tai yra, kad susidarę burbulai galėtų sprogti ir jį išleisti. Kadangi skystis visą savo energiją perkelia į dujinę būseną, jo „jėgos“ išsenka. Norint nuolat atnaujinti energiją ir pailginti virimą, į indą su skysčiu reikia tiekti vis daugiau šilumos. Katilas gali tiekti jį, dujinis degiklis ar bet koks kitas šildymo įrenginys. Verdant skysčio temperatūra nekyla, procesas vyksta garų susidarymas toje pačioje temperatūroje.
Reikalingi skirtingi skysčiai skirtingi kiekiaišilumos virsti garais. Kurią parodo savitoji garavimo šiluma.
Galite suprasti, kaip ši vertė nustatoma iš pavyzdžio. Paimkite 1 litrą vandens ir užvirinkite. Tada išmatuojame šilumos kiekį, reikalingą visam skysčiui išgaruoti, ir gauname vandens savitosios garavimo šilumos vertę. Kitiems cheminiai junginiaišis skaičius bus kitoks.
Fizikoje žymima savitoji garavimo šiluma Lotyniška raidė L. Jis matuojamas džauliais kilogramui (J/kg). Jį galima gauti padalijus išgaravimui sunaudotą šilumą iš skysčio masės:
Ši vertė yra labai svarbi gamybos procesai pagrįstas šiuolaikinės technologijos. Pavyzdžiui, metalų gamyboje jie tam skiria didžiausią dėmesį. Paaiškėjo, kad išlydžius geležį ir po to kondensuojant, toliau kietėjant susidaro stipresnė kristalinė gardelė.
Kam jis lygus
Laboratorinių tyrimų metu nustatyta įvairių medžiagų savitoji šiluminė vertė (r). Normalaus atmosferos slėgio vanduo verda 100 °C temperatūroje, o vandens garavimo šiluma yra 2258,2 kJ/kg. Šis rodiklis kai kurioms kitoms medžiagoms pateiktas lentelėje:
| Medžiaga | virimo temperatūra, °C | r, kJ/kg |
|---|---|---|
| Azotas | -196 | 198 |
| Helis | -268,94 | 20,6 |
| Vandenilis | -253 | 454 |
| Deguonis | -183 | 213 |
| Anglies | 4350 | 50000 |
| Fosforas | 280 | 400 |
| Metanas | -162 | 510 |
| Pentanas | 36 | 360 |
| Geležis | 2735 | 6340 |
| Varis | 2590 | 4790 |
| Skardos | 2430 | 2450 |
| Vadovauti | 1750 | 8600 |
| Cinkas | 907 | 1755 |
| Merkurijus | 357 | 285 |
| Auksas | 2 700 | 1 650 |
| Etanolis | 78 | 840 |
| Metilo alkoholis | 65 | 1100 |
| Chloroformas | 61 | 279 |
Tačiau šis rodiklis gali keistis dėl tam tikrų veiksnių:
- Temperatūra. Jai didėjant, garavimo šiluma mažėja ir gali būti lygi nuliui.
t, °C r, kJ/kg 2500 10 2477 20 2453 50 2380 80 2308 100 2258 200 1940 300 1405 374 115 374,15 - Spaudimas. Mažėjant slėgiui, didėja garavimo šiluma, ir atvirkščiai. Virimo temperatūra yra tiesiogiai proporcinga slėgiui ir gali pasiekti kritinę 374 °C vertę.
p, Pa t virimo., °C r, kJ/kg 0,0123 10 2477 0,1234 50 2380 1 100 2258 2 120 2202 5 152 2014 10 180 1889 20 112 1638 50 264 1638 100 311 1316 200 366 585 220 373,7 184,8 Kritinis 221,29 374,15 - - Medžiagos masė. Procese dalyvaujančios šilumos kiekis yra tiesiogiai proporcingas susidarančių garų masei.
Ryšys tarp garavimo ir kondensacijos
Fizikai išsiaiškino, kad garavimui priešingas procesas – kondensacija – garai išleidžia lygiai tiek pat energijos, kiek buvo panaudota jam susidaryti. Šis pastebėjimas patvirtina energijos tvermės dėsnį.
Priešingu atveju būtų galima sukurti instaliaciją, kurioje skystis išgaruotų, o vėliau kondensuotųsi. Skirtumas tarp šilumos, reikalingos garavimui, ir šilumos, kurios pakanka kondensacijai, lemtų energijos kaupimą, kurį būtų galima panaudoti kitiems tikslams. Iš esmės būtų sukurtas amžinasis variklis. Tačiau tai prieštarauja fiziniams dėsniams, o tai reiškia, kad tai neįmanoma.
Kaip jis matuojamas?
- Specifinė vandens garavimo šiluma matuojama eksperimentiškai fizinėse laboratorijose. Tam naudojami kalorimetrai. Procedūra atrodo taip:
- Į kalorimetrą pilamas tam tikras skysčio kiekis.
Reiškinys, kai medžiaga virsta iš skysta būsenaį dujinę vadinama garinimas. Garinimas gali būti atliekamas dviem procesais: i.
Virimas
Antrasis garinimo procesas yra virimas. Šį procesą galima stebėti naudojant paprastą eksperimentą kaitinant vandenį stiklinėje kolboje. Kaitinamas vanduo, po kurio laiko jame atsiranda burbuliukai, kuriuose yra oro ir sočiųjų vandens garų, kurie susidaro garuojant vandeniui burbuliukų viduje. Kylant temperatūrai, didėja slėgis burbuliukų viduje, o veikiami plūduriuojančios jėgos jie kyla aukštyn. Tačiau kadangi viršutinių vandens sluoksnių temperatūra žemesnė nei apatinių, burbuluose ima kondensuotis garai ir jie traukiasi. Kai vanduo sušyla per visą tūrį, burbuliukai su garais kyla į paviršių, sprogsta ir garai išeina. Vanduo verda. Tai įvyksta esant temperatūrai, kurioje sočiųjų garų slėgis burbuliukuose yra lygus atmosferos slėgiui.
Garavimo procesas, vykstantis visame skysčio tūryje tam tikroje temperatūroje, vadinamas. Temperatūra, kurioje skystis užverda, vadinama virimo taškas.
Ši temperatūra priklauso nuo atmosferos slėgio. Didėjant atmosferos slėgiui, didėja virimo temperatūra.
Patirtis rodo, kad virimo metu skysčio temperatūra nekinta, nepaisant to, kad energija ateina iš išorės. Skysčio perėjimas į dujinę būseną virimo temperatūroje yra susijęs su atstumo tarp molekulių padidėjimu ir atitinkamai su traukos tarp jų įveikimu. Skysčiui tiekiama energija sunaudojama darbams atlikti, siekiant įveikti traukos jėgas. Tai vyksta tol, kol visas skystis virsta garais. Kadangi skysčio ir garų temperatūra virimo metu yra vienoda, vidutinė kinetinė energija molekulės nesikeičia, tik didėja jų potenciali energija.
Paveikslėlyje parodytas vandens temperatūros ir laiko grafikas kaitinant nuo kambario temperatūros iki virimo temperatūros (AB), virimo temperatūros (BC), kaitinant garais (CD), aušinant garais (DE), kondensacijos (EF) ir vėlesnio aušinimo metu. (FG) .
Savitoji garavimo šiluma
Norint paversti skirtingas medžiagas iš skystos į dujinę būseną, reikalinga skirtinga energija, ši energija apibūdinama dydžiu, vadinama specifine garavimo šiluma.
Savitoji garavimo šiluma (L) – tai vertė, lygi šilumos kiekio, kuris turi būti perduotas 1 kg sveriančiai medžiagai, santykiui, kad virimo temperatūroje ji iš skystos būsenos virstų dujine.
Savitosios garavimo šilumos vienetas – [ L] = J/kg.
Norint apskaičiuoti šilumos kiekį Q, kuris turi būti perduotas medžiagai, kurios masė mn, kad ji virstų iš skystos į dujinę būseną, specifinė garavimo šiluma ( L) padaugintas iš medžiagos masės: Q = Lm.
Kondensuojantis garams išsiskiria tam tikras šilumos kiekis, o jo reikšmė lygi šilumos kiekiui, kurį reikia išleisti, kad skystis pavirstų tos pačios temperatūros garais.
Virimas – tai intensyvus garavimas, atsirandantis kaitinant skystį ne tik nuo paviršiaus, bet ir jo viduje.
Virimas įvyksta absorbuojant šilumą.
Didžioji dalis tiekiamos šilumos išleidžiama ryšiams tarp medžiagos dalelių nutraukti, likusi dalis - darbui, atliekamam garų plėtimosi metu.
Dėl to sąveikos energija tarp garų dalelių tampa didesnė nei tarp skystųjų dalelių, todėl garų vidinė energija yra didesnė nei skysčio vidinė energija toje pačioje temperatūroje.
Šilumos kiekį, reikalingą skysčiui paversti garais virimo metu, galima apskaičiuoti pagal formulę:

kur m yra skysčio masė (kg),
L yra savitoji garavimo šiluma.
Savitoji garavimo šiluma parodo, kiek šilumos reikia, kad 1 kg tam tikros medžiagos virimo temperatūroje virstų garais. Savitosios garavimo šilumos vienetas SI sistemoje:
[L] = 1 J/kg
Didėjant slėgiui, skysčio virimo temperatūra didėja, o savitoji garavimo šiluma mažėja ir atvirkščiai.

Verdant skysčio temperatūra nekinta.
Virimo temperatūra priklauso nuo skysčio slėgio.
Kiekviena medžiaga, esanti to paties slėgio, turi savo virimo temperatūrą.
Didėjant atmosferos slėgiui, virimas prasideda aukštesnėje temperatūroje, o sumažėjus slėgiui, atvirkščiai.
Pavyzdžiui, vanduo užverda 100 °C temperatūroje tik esant normaliam atmosferos slėgiui.
KAS VYKSTA SKYSČIO VIDUJE VIRANT?

Virimas – tai skysčio perėjimas į garus, kai skystyje nuolat susidaro ir auga garų burbuliukai, į kuriuos skystis išgaruoja. Šildymo pradžioje vanduo yra prisotintas oro ir yra kambario temperatūros. Kaitinamas vanduo, jame ištirpusios dujos išleidžiamos indo dugne ir sienelėse, susidaro oro burbuliukai. Jie pradeda pasirodyti ilgai prieš verdant. Vanduo išgaruoja į šiuos burbuliukus. Garų pripildytas burbulas ima brinkti esant pakankamai aukštai temperatūrai.

Pasiekęs tam tikrą dydį, jis atitrūksta nuo dugno, pakyla į vandens paviršių ir sprogsta. Tokiu atveju garai palieka skystį. Jei vanduo nepakankamai pašildomas, garų burbulas, pakilęs į šaltus sluoksnius, subyra. Dėl vandens svyravimų visame vandens tūryje atsiranda daugybė mažų oro burbuliukų: vadinamasis „baltasis raktas“.

Oro burbulas, kurio tūris yra indo apačioje, yra paveiktas pakelti:
Finansuotojas = Farchimedas – Fgravitacija
Burbulas prispaudžiamas prie dugno, nes apatinis paviršius slėgio jėgos neveikia. Kaitinamas, burbulas plečiasi dėl į jį išsiskiriančių dujų ir atitrūksta nuo dugno, kai kėlimo jėga yra šiek tiek didesnė už spaudimo jėgą. Burbulo, kuris gali atitrūkti nuo dugno, dydis priklauso nuo jo formos. Dugne esančių burbuliukų formą lemia indo dugno drėgnumas.
Dėl nehomogeniškumo ir burbuliukų susiliejimo apačioje padidėjo jų dydis. At dideli dydžiai Kai burbulas kyla, už jo susidaro tuštumos, plyšimai ir turbulencijos.
Kai burbulas sprogsta, visas jį supantis skystis veržiasi į vidų, sukurdamas žiedinę bangą. Uždarius išmeta vandens stulpelį.

Kai sprogsta burbuliukai subyra, skystyje sklinda ultragarso dažnių smūginės bangos, kurias lydi garsinis triukšmas. Pradinėms virimo stadijoms būdingi garsiausi ir aukščiausi garsai ("scenoje" baltas raktas„Arbatinukas dainuoja“).
(šaltinis: virlib.eunnet.net)
VANDENS BŪKLĖS POKYČIŲ TEMPERATŪROS GRAFIKAS

PAŽIŪRĖKITE Į KNYGŲ LENTYNĄ!
ĮDOMUS
Kodėl arbatinuko dangtyje daro skylę?
Norėdami išleisti garus. Jei dangtyje nėra skylės, iš virdulio snapelio garai gali ištaškyti vandenį.
___
Bulvių virimo trukmė, pradedant nuo virimo momento, nepriklauso nuo šildytuvo galios. Trukmė nustatoma pagal laiką, kai produktas išlieka virimo temperatūroje.
Šildytuvo galia neturi įtakos virimo temperatūrai, o tik vandens garavimo greičiui.
Verdant vanduo gali užšalti. Norėdami tai padaryti, iš indo, kuriame yra vanduo, reikia išpumpuoti orą ir vandens garus, kad vanduo visą laiką virtų.
„Puodai lengvai verda per kraštą – blogas oras!
Atmosferos slėgio kritimas, lydimas blogėjančių oro sąlygų, yra priežastis, dėl kurios pienas „bėga“ greičiau.
___
Labai karšto verdančio vandens galima gauti giluminių kasyklų dugne, kur oro slėgis daug didesnis nei Žemės paviršiuje. Taigi 300 m gylyje vanduo užvirs 101 ͦ C temperatūroje. Esant 14 atmosferų oro slėgiui, vanduo užverda 200 ͦ C temperatūroje.
Po oro siurblio varpeliu galite gauti „verdantį vandenį“, kurio temperatūra yra 20 ° C.
Marse gertume „verdantį vandenį“, kurio temperatūra yra 45 °C.
Sūrus vanduo užverda aukštesnėje nei 100 ͦ C temperatūroje. ___
Kalnuotuose regionuose dideliame aukštyje ir esant žemam atmosferos slėgiui vanduo užverda žemesnėje nei 100 ͦ Celsijaus temperatūroje.

Ilgiau reikia laukti, kol toks patiekalas iškeps.
Užpilkite šaltu vandeniu... ir užvirs!
Paprastai vanduo užverda 100 laipsnių Celsijaus temperatūroje. Vandenį kolboje kaitinkite ant degiklio, kol užvirs. Išjungiame degiklį. Vanduo nustoja virti. Uždarykite kolbą kamščiu ir pradėkite atsargiai srovele pilti šaltą vandenį ant kamščio. kaip tai atrodo? Vanduo vėl verda!
..............................Po upeliu saltas vanduo kolboje esantis vanduo, o kartu su juo pradeda vėsti vandens garai.
Garų tūris mažėja, o slėgis virš vandens paviršiaus keičiasi...
Kokia kryptimi manote?
... Vandens virimo temperatūra sumažintame slėgyje yra mažesnė nei 100 laipsnių, ir vanduo kolboje vėl užverda!
____
Gaminant slėgis keptuvės – „slėginės viryklės“ – viduje yra apie 200 kPa, o sriuba tokioje keptuvėje išvirs daug greičiau.
Galite užpildyti švirkštą vandeniu maždaug iki pusės, uždaryti jį tuo pačiu kamščiu ir staigiai patraukti stūmoklį. Vandenyje atsiras burbuliukų masė, rodanti, kad prasidėjo vandens virimo procesas (ir tai yra kambario temperatūros!).
___
Kai medžiaga pereina į dujinę būseną, jos tankis sumažėja apie 1000 kartų.
___
Pirmieji elektriniai virduliai turėjo šildytuvus po dugnu. Vanduo nesiliečia su šildytuvu ir užvirė labai ilgai. 1923 m. Arthuras Large'as padarė atradimą: jis įdėjo šildytuvą į specialųjį varinis vamzdis ir įdėjo į arbatinuką. Vanduo greitai užvirė.
JAV buvo sukurtos savaime auštančios gaiviųjų gėrimų skardinės. Stiklainis turi skyrių, kuriame įmontuotas žemai verdantis skystis. Karštą dieną susmulkinus kapsulę, skystis ims greitai virti, atimdamas šilumą nuo indelio turinio, o per 90 sekundžių gėrimo temperatūra nukris 20-25 laipsniais Celsijaus.
NA, KODĖL TAIP?
Kaip manote, ar galima kietai virti kiaušinį, jei vanduo verda žemesnėje nei 100 laipsnių Celsijaus temperatūroje?
____
Ar užvirs vanduo puode, kuris plūduriuoja kitame verdančio vandens puode?
Kodėl? ___
Ar galima vandenį užvirti nekaitinant?

Šios žinios greitai išnyksta, ir pamažu žmonės nustoja kreipti dėmesį į pažįstamų reiškinių esmę. Kartais pravartu prisiminti teorines žinias.
Apibrėžimas
Kas yra verda? Tai fizinis procesas, kurio metu vyksta intensyvus garavimas tiek laisvajame skysčio paviršiuje, tiek jo struktūros viduje. Vienas iš virimo požymių yra burbuliukų, susidedančių iš sočiųjų garų ir oro, susidarymas.
Verta paminėti, kad egzistuoja tokia sąvoka kaip virimo temperatūra. Garų susidarymo greitis taip pat priklauso nuo slėgio. Jis turi būti nuolatinis. Kaip taisyklė, pagrindinė skysčių savybė cheminių medžiagų yra virimo temperatūra esant normaliam atmosferos slėgiui. Tačiau šiam procesui įtakos gali turėti ir tokie veiksniai kaip garso bangų intensyvumas ir oro jonizacija.
Vandens virimo etapai
Garai tikrai pradės formuotis atliekant tokią procedūrą kaip kaitinimas. Virimas apima skysčio pratekėjimą per 4 etapus:
- Indo apačioje, taip pat ant jo sienelių pradeda formuotis maži burbuliukai. Taip yra dėl to, kad medžiagos, iš kurios pagamintas indas, plyšiuose yra oro, kuris plečiasi veikiant aukštai temperatūrai.
- Burbuliukų tūris pradeda didėti, todėl jie sprogsta į vandens paviršių. Jeigu viršutinis sluoksnis Skystis dar nepasiekė virimo temperatūros, ertmės nugrimzta į dugną, o po to vėl pradeda siekti aukštyn. Dėl šio proceso susidaro garso bangos. Štai kodėl mes girdime triukšmą, kai vanduo verda.
- Išplaukia į paviršių didžiausias skaičius burbuliukai, o tai sukuria įspūdį. Po to skystis pasidaro blyškus. Atsižvelgiant į vizualinis efektas, šis virimo etapas vadinamas „baltuoju raktu“.
- Pastebimas intensyvus virpėjimas, kurį lydi didelių burbuliukų, kurie greitai sprogsta, susidarymas. Šį procesą lydi purslų atsiradimas, taip pat intensyvus garų susidarymas.

Savitoji garavimo šiluma
Beveik kiekvieną dieną susiduriame su tokiu reiškiniu kaip virimas. Savitoji garavimo šiluma yra fizinis kiekis, kuris lemia šilumos kiekį. Su jo pagalba skysta medžiaga gali būti paversta garais. Norint apskaičiuoti šį parametrą, garavimo šilumą reikia padalyti iš masės.
Kaip vyksta matavimas?
Specifinis rodiklis matuojamas laboratorinėmis sąlygomis, atliekant atitinkamus eksperimentus. Tai apima:
- išmatuotas reikalinga suma skystis, kuris vėliau pilamas į kalorimetrą;
- atliekamas pirminis vandens temperatūros matavimas;
- ant degiklio įdedama kolba su anksčiau įdėta tiriamąja medžiaga;
- bandomosios medžiagos išskiriami garai paleidžiami į kalorimetrą;
- pakartotinai išmatuojama vandens temperatūra;
- Kalorimetras pasveriamas, todėl galima apskaičiuoti kondensuotų garų masę.

Burbulinio virimo režimas
Sprendžiant klausimą, kas yra virimas, verta paminėti, kad jis turi keletą režimų. Taigi, kaitinant, garai gali susidaryti burbuliukų pavidalu. Jie periodiškai auga ir sprogsta. Šis virimo režimas vadinamas branduoliniu virimu. Paprastai ertmės, užpildytos garais, susidaro būtent ties indo sienelėmis. Taip yra dėl to, kad jie dažniausiai būna perkaitinti. Tai būtina sąlyga virimui, nes kitaip burbuliukai subyrės nepasiekdami didelių dydžių.

Plėvelės virimo režimas
Kas yra verda? Lengviausias būdas paaiškinti šį procesą yra garinimas tam tikroje temperatūroje ir pastovus slėgis. Be burbulo režimo, yra ir filmavimo režimas. Jo esmė ta, kad sustiprėjus šilumos srautas atskiri burbuliukai susijungia ir sudaro garų sluoksnį ant indo sienelių. Pasiekus kritinį rodiklį, jie prasiskverbia į vandens paviršių. Šis virimo režimas skiriasi tuo, kad žymiai sumažėja šilumos perdavimo iš indo sienelių į patį skystį laipsnis. To priežastis – ta pati garų plėvelė.
Virimo temperatūra
Verta paminėti, kad virimo temperatūra priklauso nuo slėgio, veikiančio šildomo skysčio paviršių. Taigi visuotinai priimta, kad vanduo užverda, kai įkaista iki 100 laipsnių Celsijaus. Tačiau šis rodiklis gali būti laikomas teisingu tik tuo atveju, jei atmosferos slėgis laikomas normaliu (101 kPa). Jei jis padidės, virimo temperatūra taip pat pasikeis aukštyn. Pavyzdžiui, populiariose greitpuodėse slėgis yra apie 200 kPa. Taigi, virimo temperatūra padidėja 20 taškų (iki 20 laipsnių).
Žemo atmosferos slėgio pavyzdys yra kalnuotos vietovės. Taigi, atsižvelgiant į tai, kad jis ten yra gana mažas, vanduo pradeda virti maždaug 90 laipsnių temperatūroje. Tokių vietovių gyventojams maisto ruošimui tenka skirti kur kas daugiau laiko. Taigi, pavyzdžiui, norint išvirti kiaušinį, vandenį teks pašildyti bent 100 laipsnių, antraip baltymas nesukrešės.
Medžiagos virimo temperatūra priklauso nuo sočiųjų garų slėgio. Jo poveikis temperatūrai yra atvirkščiai proporcingas. Pavyzdžiui, gyvsidabris užverda kaitinant iki 357 laipsnių Celsijaus. Tai galima paaiškinti tuo, kad sočiųjų garų slėgis yra tik 114 Pa (vandeniui šis skaičius yra 101 325 Pa).

Virimas skirtingomis sąlygomis
Priklausomai nuo sąlygų ir skysčio būklės, virimo temperatūra gali labai skirtis. Pavyzdžiui, į skystį verta įberti druskos. Chloro ir natrio jonai yra tarp vandens molekulių. Taigi virimui reikia daugiau energijos ir atitinkamai daugiau laiko. Be to, toks vanduo gamina daug mažiau garų.
Virdulys naudojamas vandeniui užvirti gyvenimo sąlygos. Jei naudojamas grynas skystis, tada temperatūra šis procesas yra standartinis 100 laipsnių. Panašiomis sąlygomis distiliuotas vanduo užverda. Tačiau tai užtruks šiek tiek mažiau laiko, nes nėra pašalinių priemaišų.
Kuo skiriasi virinimas ir garinimas?
Kai vanduo užverda, į atmosferą patenka garai. Tačiau šių dviejų procesų neįmanoma nustatyti. Tai tik garinimo būdai, kurie vyksta tam tikromis sąlygomis. Taigi, virimas yra pirmos rūšies. Šis procesas yra intensyvesnis, nei sukelia garų kišenių susidarymas. Taip pat verta paminėti, kad garavimo procesas vyksta tik vandens paviršiuje. Virimas apima visą skysčio tūrį.

Nuo ko priklauso garavimas?
Garinimas yra skystos arba kietos medžiagos pavertimo dujine būsena procesas. Vyksta atomų ir molekulių „skrydis“, kurių ryšys su kitomis dalelėmis tam tikromis sąlygomis susilpnėja. Garavimo greitis gali skirtis dėl šių veiksnių:
- skysčio paviršiaus plotas;
- pačios medžiagos, taip pat aplinkos temperatūra;
- molekulių judėjimo greitis;
- medžiagos tipas.
Verdančio vandens energiją žmonės plačiai naudoja kasdieniame gyvenime. Šis procesas tapo toks įprastas ir pažįstamas, kad niekas nesusimąsto apie jo prigimtį ir ypatybes. Nepaisant to, su virimu siejama keletas įdomių faktų:
- Turbūt visi pastebėjo, kad virdulio dangtelyje yra skylė, tačiau apie jos paskirtį mažai kas susimąsto. Tai daroma siekiant iš dalies išleisti garą. Priešingu atveju pro snapelį gali išsitaškyti vanduo.
- Bulvių, kiaušinių ir kitų maisto produktų kepimo trukmė nepriklauso nuo šildytuvo galingumo. Svarbu tik tai, kiek laiko jie buvo veikiami verdančiu vandeniu.
- Tokiam indikatoriui kaip virimo temperatūra neturi įtakos galia. šildymo prietaisas. Tai gali turėti įtakos tik skysčio išgaravimo greičiui.
- Virimas – tai ne tik vandens šildymas. Šis procesas taip pat gali sukelti skysčio užšalimą. Taigi, virimo metu būtina nuolat pumpuoti orą iš indo.
- Vienas is labiausiai dabartines problemas namų šeimininkėms yra tai, kad pienas gali "pabėgti". Taigi, šio reiškinio rizika žymiai padidėja blogėjant orams, kuriuos lydi atmosferos slėgio kritimas.
- Karščiausias verdantis vanduo gaunamas giliose požeminėse kasyklose.
- Autorius eksperimentiniai tyrimai Mokslininkams pavyko nustatyti, kad Marse vanduo užverda 45 laipsnių Celsijaus temperatūroje.

Ar vanduo gali virti kambario temperatūroje?
Atlikdami paprastus skaičiavimus, mokslininkai sugebėjo nustatyti, kad vanduo gali užvirti stratosferos lygyje. Panašias sąlygas galima atkurti naudojant vakuuminis siurblys. Nepaisant to, panašų eksperimentą galima atlikti paprastesnėmis, kasdieniškesnėmis sąlygomis.
Litro kolboje reikia užvirinti 200 ml vandens, o pripildžius indą garais, jį reikia sandariai uždaryti ir nukelti nuo ugnies. Padėję jį virš kristalizatoriaus, turite palaukti, kol baigsis virimo procesas. Toliau kolba pilama saltas vanduo. Po to inde vėl prasidės intensyvus virimas. Taip yra dėl to, kad esant žemai temperatūrai, garai, esantys viršutinėje kolbos dalyje, nusileidžia.














