Ligevægtskonstant for en kemisk reaktion. Bestemmelse af ligevægtskonstanter for kemiske reaktioner og beregning af kemisk ligevægt
Konstant kemisk ligevægt
Alle kemiske reaktioner kan opdeles i 2 grupper: irreversible reaktioner, dvs. forløber indtil et af de reagerende stoffer er fuldstændigt opbrugt, og reversible reaktioner, hvor ingen af de reagerende stoffer er fuldstændigt forbrugt. Dette skyldes det faktum, at en irreversibel reaktion kun opstår i én retning. En reversibel reaktion kan forekomme både direkte og omvendt retning. For eksempel reaktion
Zn + H2SO4® ZnSO4 + H2
fortsætter indtil den fuldstændige forsvinden af enten svovlsyre eller zink og strømmer ikke i den modsatte retning: metallisk zink og svovlsyre kan ikke opnås ved at føre brint ind i en vandig opløsning af zinksulfat. Derfor er denne reaktion irreversibel.
Klassisk eksempel En reversibel reaktion kan være syntesen af ammoniak fra nitrogen og brint: N 2 + 3 H 2 ⇆ 2 NH 3 .
Hvis man blander 1 mol nitrogen og 3 mol brint ved høj temperatur, så vil selv efter en tilstrækkelig lang reaktionstid ikke kun reaktionsproduktet (NH 3), men også ureagerede udgangsstoffer (N 2 og H 2) vil være til stede i reaktoren. Hvis der under de samme forhold ikke indføres en blanding af nitrogen og brint, men ren ammoniak i reaktoren, så viser det sig efter nogen tid, at en del af ammoniakken er nedbrudt til nitrogen og brint, dvs. reaktionen forløber i den modsatte retning.
For at forstå karakteren af kemisk ligevægt er det nødvendigt at overveje hastigheden af fremadrettede og omvendte reaktioner. Hastigheden af en kemisk reaktion er ændringen i koncentrationen af udgangsstoffet eller reaktionsproduktet pr. tidsenhed. Når man studerer spørgsmål om kemisk ligevægt, er koncentrationerne af stoffer udtrykt i mol/l; disse koncentrationer viser, hvor mange mol af en given reaktant der er indeholdt i 1 liter beholder. Eksempelvis betyder udsagnet ”ammoniakkoncentrationen er 3 mol/l”, at hver liter af det pågældende rumfang indeholder 3 mol ammoniak.
Kemiske reaktioner udføres som et resultat af kollisioner mellem molekyler, og jo flere molekyler der er i en enhedsvolumen, jo oftere forekommer kollisioner mellem dem, og jo større er reaktionshastigheden. Jo større koncentrationen af reaktanter er, jo større er reaktionshastigheden.
der observeres ingen ligevægt i systemet
Der er ingen synlige ændringer.
Eksempelvis kan koncentrationerne af alle stoffer forblive uændrede i uendelig lang tid, hvis der ikke er en ekstern påvirkning af systemet. Denne konstanthed af koncentrationer i et system i en tilstand af kemisk ligevægt betyder slet ikke fraværet af interaktion og forklares ved, at fremadgående og omvendte reaktioner forløber med samme hastighed. Denne tilstand kaldes også ægte kemisk ligevægt. Således er ægte kemisk ligevægt en dynamisk ligevægt.
Falsk ligevægt skal skelnes fra sand ligevægt. Konstansen af systemparametre (koncentrationer af stoffer, tryk, temperatur) er et nødvendigt, men utilstrækkeligt tegn på ægte kemisk ligevægt. Dette kan illustreres med følgende eksempel. Interaktionen mellem nitrogen og brint med dannelsen af ammoniak, såvel som nedbrydningen af ammoniak, sker med en mærkbar hastighed ved høje temperaturer (ca. 500 ° C). Hvis du blander brint, nitrogen og ammoniak i et hvilket som helst forhold ved stuetemperatur, så er reaktionen N 2 + 3 H 2 ⇆ 2 NH 3
vil ikke lække, og alle systemparametre vil opretholde en konstant værdi. Dog i i dette tilfælde ligevægten er falsk, ikke sand, fordi den er ikke dynamisk; Der er ingen kemisk vekselvirkning i systemet: hastigheden af både fremadgående og omvendte reaktioner er nul.
I den videre præsentation af materialet vil udtrykket "kemisk ligevægt" blive brugt i forhold til ægte kemisk ligevægt.
En kvantitativ karakteristik af et system i en tilstand af kemisk ligevægt er ligevægtskonstant K .
For det generelle tilfælde af en reversibel reaktion a A + b B + ... ⇆ p P + q Q + ...
Ligevægtskonstanten er udtrykt med følgende formel:
I formel 5.1 er C(A), C(B), C(P), C(Q) ligevægtskoncentrationerne (mol/l) af alle stoffer, der deltager i reaktionen, dvs. koncentrationer, der er etableret i systemet i øjeblikket af kemisk ligevægt; a, b, p, q – støkiometriske koefficienter i reaktionsligningen.
Udtrykket for ligevægtskonstanten for ammoniaksyntesereaktionen N 2 +3H 2 ⇆2NH 3 har følgende form: . (5.2)
Den numeriske værdi af den kemiske ligevægtskonstant er således lig med forholdet mellem produktet af ligevægtskoncentrationerne af reaktionsprodukterne og produktet af udgangsstoffernes ligevægtskoncentrationer, og koncentrationen af hvert stof skal hæves til en potens lig med den støkiometriske koefficient i reaktionsligningen.
Det er vigtigt at forstå det ligevægtskonstanten er udtrykt i ligevægtskoncentrationer, men afhænger ikke af dem ; tværtimod vil forholdet mellem ligevægtskoncentrationerne af de stoffer, der deltager i reaktionen, være sådan, at det svarer til ligevægtskonstanten. Ligevægtskonstanten afhænger af arten af reaktanterne og temperaturen og er en konstant (kl konstant temperatur) værdi .
Hvis K >> 1, så er tælleren for brøkdelen af ligevægtskonstanten-udtrykket mange gange større end nævneren, derfor dominerer reaktionsprodukter i systemet i ligevægtsøjeblikket, dvs. reaktionen forløber stort set i fremadgående retning.
Hvis K<< 1, то знаменатель во много раз превышает числитель, следовательно, в момент равновесия в системе преобладают исходные вещества, т.е. реакция лишь в незначительной степени протекает в прямом направлении.
Hvis K ≈ 1, så er ligevægtskoncentrationerne af udgangsstofferne og reaktionsprodukterne sammenlignelige; reaktionen forløber i mærkbar udstrækning i både fremadgående og tilbagegående retning.
Man skal huske på, at udtrykket for ligevægtskonstanten kun omfatter koncentrationerne af de stoffer, der er i gasfasen eller i opløst tilstand (hvis reaktionen sker i opløsning). Hvis et fast stof er involveret i reaktionen, så sker interaktionen på dets overflade, derfor antages koncentrationen af det faste stof at være konstant og skrives ikke ind i udtrykket for ligevægtskonstanten.
CO 2 (gas) + C (fast) ⇆ 2 CO (gas)
CaCO 3 (fast) ⇆ CaO (fast) + CO 2 (gas) K = C(CO 2)
Ca 3 (PO 4) 2 (fast) ⇆ 3Ca 2+ (opløsning) + 2PO 4 3– (opløsning) K = C 3 (Ca 2+) C 2 (PO 4 3–)
Kemisk ligevægt er en tilstand af reversibel kemisk reaktion.
aA+ b B= c C+ d D,
hvor der ikke er nogen ændring i koncentrationerne af reaktanter i reaktionsblandingen over tid. Tilstanden af kemisk ligevægt er karakteriseret kemisk ligevægtskonstant:
Hvor C i– koncentration af komponenter i ligevægt den perfekte blanding.
Ligevægtskonstanten kan også udtrykkes i form af ligevægtsmolfraktioner X i komponenter:
For reaktioner, der forekommer i gasfasen, er det praktisk at udtrykke ligevægtskonstanten i form af ligevægtspartialtryk P i komponenter:
Til ideelle gasser P i = C i RT Og P i = X og P, Hvor P er derfor det samlede tryk KP, K C Og K X er forbundet med følgende forhold:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Ligevægtskonstanten er relateret til r G o kemisk reaktion:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Forandring r G eller r F i en kemisk reaktion ved givne (ikke nødvendigvis ligevægts) partialtryk P i eller koncentrationer C i komponenter kan beregnes ved hjælp af ligningen kemiske reaktionsisotermer (van't Hoff isotermer):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Ifølge Le Chateliers princip, hvis en ydre påvirkning udøves på et system, der er i ligevægt, så vil ligevægten forskydes for at reducere effekten af den ydre påvirkning. En stigning i tryk flytter således ligevægten mod et fald i antallet af gasmolekyler. Tilføjelse af en hvilken som helst reaktionskomponent til en ligevægtsblanding flytter ligevægten mod et fald i mængden af denne komponent. En stigning (eller et fald) i temperaturen flytter ligevægten mod en reaktion, der opstår med absorption (frigivelse) af varme.
Ligevægtskonstantens kvantitative afhængighed af temperaturen er beskrevet ved ligningen kemisk reaktion isobarer (van't Hoff isobarer)
![]() (9.9)
(9.9)
Og isokorer af en kemisk reaktion (van't Hoff isochores)
![]() . (9.10)
. (9.10)
Integrationsligning (9.9) under den antagelse, at r H reaktion afhænger ikke af temperatur (hvilket er sandt i snævre temperaturområder), giver:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Hvor C – integrationskonstant. Således er afhængigheden ln K P fra 1 /T skal være lineær, og hældningen af den rette linje er - r H/R.
Integration indenfor K 1 , K 2, og T 1, T 2 giver:
 (9.13)
(9.13)
 (9.14)
(9.14)
Ved at bruge denne ligning, ved at kende ligevægtskonstanterne ved to forskellige temperaturer, kan vi beregne r H reaktioner. Derfor at vide r H reaktioner og ligevægtskonstanten ved én temperatur, kan man beregne ligevægtskonstanten ved en anden temperatur.
EKSEMPLER
CO(g) + 2H2 (g) = CH3OH(g)
ved 500K. f G o for CO(g) og CH 3 OH(g) ved 500 K er lig med –155,41 kJ. mol –1 og –134,20 kJ. mol –1 hhv.
Løsning. G o reaktioner:
r G o= f G o(CH 3 OH) – f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Eksempel 9-2. Reaktionsligevægtskonstant
lig med K P = 1,64 10 –4 ved 400 o C. Hvilket totaltryk skal der påføres en ækvimolær blanding af N 2 og H 2, så 10 % af N 2 bliver til NH 3? Gasser betragtes som ideelle.
Løsning. Lad et mol N 2 reagere. Så
| N 2 (g) | + | 3H 2 (g) | = | 2NH 3 (g) | |
| Original mængde | 1 | 1 | |||
| Ligevægtsmængde | 1– | 1–3 | 2 (i alt: 2-2) | ||
| Ligevægt molfraktion: |
Derfor, K X = 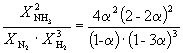 Og K P = K X . P –2
=
Og K P = K X . P –2
=  .
.
At substituere = 0,1 i den resulterende formel, har vi
1.64 10 –4 = , hvor P= 51,2 atm.
, hvor P= 51,2 atm.
Eksempel 9-3. Reaktionsligevægtskonstant
CO(g) + 2H2 (g) = CH3OH(g)
ved 500 K er lig med K P = 6,09 10 –3. En reaktionsblanding bestående af 1 mol CO, 2 mol H 2 og 1 mol inert gas (N 2) opvarmes til 500 K og et samlet tryk på 100 atm. Beregn sammensætningen af ligevægtsblandingen.
Løsning. Lad et mol CO reagere. Så
| CO(g) | + | 2H 2 (g) | = | CH3OH(g) | |
| Original mængde: | 1 | 2 | 0 | ||
| Ligevægtsmængde: | 1– | 2–2 | |||
| Total i ligevægtsblanding: | 3–2 mol komponenter + 1 mol N 2 = 4–2 mol | ||||
| Ligevægts molfraktion | |||||
Derfor, K X =  Og K P = K X . P–2 =
Og K P = K X . P–2 = ![]() .
.
Således 6,09 10 –3 = ![]() .
.
Løser vi denne ligning, får vi = 0,732. Følgelig er molfraktionerne af stoffer i ligevægtsblandingen lig med: = 0,288, = 0,106, = 0,212 og = 0,394.
Eksempel 9-4. Til reaktion
N2 (g) + 3H2 (g) = 2NH3 (g)
ved 298 K K P = 6,0 105, a f H o(NH3) = -46,1 kJ. mol –1. Estimer værdien af ligevægtskonstanten ved 500 K.
Løsning. Reaktionens standard molære entalpi er
r H o= 2f H o(NH3) = -92,2 kJ. mol –1.
Ifølge ligning (9.14),  =
=
Ln (6,0 105)+ ![]() = –1,73, hvorfra K 2 =
0.18.
= –1,73, hvorfra K 2 =
0.18.
Bemærk, at ligevægtskonstanten for en eksoterm reaktion falder med stigende temperatur, hvilket svarer til Le Chateliers princip.
OPGAVER
- Ved 1273 K og et samlet tryk på 30 atm i en ligevægtsblanding
- Ved 2000 o C og et samlet tryk på 1 atm dissocieres 2 % af vandet til brint og ilt. Beregn ligevægtskonstanten for reaktionen
- Reaktionsligevægtskonstant
- Reaktionsligevægtskonstant
- En 3-liters beholder indeholdende 1,79 10 –2 mol I 2 blev opvarmet til 973 K. Trykket i beholderen ved ligevægt viste sig at være 0,49 atm. Forudsat at gasser er ideelle, beregne ligevægtskonstanten ved 973 K for reaktionen
- Til reaktion
- Til reaktion
- En 1-liters beholder indeholdende 0,341 mol PCl 5 og 0,233 mol N 2 blev opvarmet til 250 o C. Det samlede tryk i beholderen ved ligevægt viste sig at være 29,33 atm. Hvis det antages, at alle gasser er ideelle, beregnes ligevægtskonstanten ved 250 o C for reaktionen i beholderen
- Reaktionsligevægtskonstant
- Ved 25 o C f G o(NH3) = -16,5 kJ. mol –1. r G Beregne
- reaktioner med dannelse af NH 3 ved partialtryk på N 2, H 2 og NH 3 lig med henholdsvis 3 atm, 1 atm og 4 atm. I hvilken retning vil reaktionen forløbe spontant under disse forhold?
- Ligevægtskonstanten for gasfasereaktionen af isomerisering af borneol (C 10 H 17 OH) til isoborneol er 0,106 ved 503 K. En blanding af 7,5 g borneol og 14,0 g isoborneol blev anbragt i en 5-liters beholder og opbevaret ved 503 K indtil ligevægt var opnået.
- Beregn molfraktionerne og masserne af borneol og isoborneol i ligevægtsblandingen.
- til reaktion. Ved hvilket totaltryk vil partialtrykket af Cl 2 være lig med 0,10 bar?
- ved 400 o C er lig
- Hvad bliver graden af dissociation af PCl 5, hvis N 2 tilsættes systemet, så partialtrykket af nitrogen er 0,9 atm?
- N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3. - En ligevægtsblanding af N 2, O 2, NO og inert gas ved et samlet tryk på 1 bar indeholder 80 % (vol.) N 2 og 16 % O 2.
CO 2 (g) + C(tv) = 2CO(g)
indeholder 17 % (vol.) CO 2 . Hvor mange procent CO 2 vil der være indeholdt i gassen ved et samlet tryk på 20 atm? Ved hvilket tryk vil gassen indeholde 25 % CO 2?
H 2 O (g) = H 2 (g) + 1/2 O 2 (g) under disse betingelser.
CO(g) + H 2 O(g) = CO 2 (g) + H 2 (g)
ved 500 o C er lig Kp= 5,5. En blanding bestående af 1 mol CO og 5 mol H2O blev opvarmet til denne temperatur. Beregn molfraktionen af H 2 O i ligevægtsblandingen.
N 2 O 4 (g) = 2NO 2 (g)
ved 25 o C er lig Kp= 0,143. Beregn det tryk, der vil blive etableret i en beholder med et volumen på 1 liter, hvori 1 g N 2 O 4 blev anbragt ved denne temperatur.
I2(g) = 2I (g).
ved 250 o C r G o = -2508 J mol -1. Ved hvilket totaltryk vil omdannelsesgraden af PCl 5 til PCl 3 og Cl 2 ved 250 o C være 30 %?
2HI(g) = H2(g) + I2(g)
ligevægtskonstant K P = 1,83 10 –2 ved 698,6 K. Hvor mange gram HI dannes, når 10 g I 2 og 0,2 g H 2 opvarmes til denne temperatur i en tre-liters beholder? Hvad er partialtrykket for H 2, I 2 og HI?
PCl5 (g) = PCl3 (g) + Cl2 (g)
CO(g) + 2H2 (g) = CH3OH(g)
ved 500 K er lig med K P = 6,09 10 –3. Beregn det totale tryk, der kræves for at producere methanol i 90 % udbytte, hvis CO og H2 tages i forholdet 1:2.
CO(g) + 2H2 (g) = CH3OH(g)
Eksoterm reaktion T er i ligevægt ved 500 K og 10 bar. Hvis gasserne er ideelle, hvordan vil følgende faktorer påvirke udbyttet af methanol: a) stige P; b) forfremmelse ; c) tilsætning af inert gas ved V P= const; P d) tilsætning af inert gas ved
Ligevægt i reaktion
2NOCl(g) = 2NO(g) + Cl2(g) r G o indstillet til 227 o C og et totaltryk på 1,0 bar, når partialtrykket af NOCl er 0,64 bar (i første omgang var der kun NOCl til stede). Beregne
N2 (g) + 3H2 (g) = 2NH3 (g)
Beregn det totale tryk, der skal påføres en blanding af 3 dele H 2 og 1 del N 2 for at opnå en ligevægtsblanding indeholdende 10 % NH 3 efter volumen ved 400 o C. Ligevægtskonstant for reaktionen K = 1.60 10 –4 .
Ved 250 o C og et samlet tryk på 1 atm dissocieres PCl 5 med 80 % af reaktionen
PCl5 (g) = PCl3 (g) + Cl2 (g).
Det totale tryk holdes på 1 atm.
Ved 2000 o C til reaktion
Hvor stor en volumenprocent er NEJ? Hvad er partialtrykket af en inert gas? K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Beregn standardentalpien for reaktionen, for hvilken ligevægtskonstanten er
a) stiger 2 gange, b) falder 2 gange, når temperaturen skifter fra 298 K til 308 K. · Afhængigheden af ligevægtskonstanten for reaktionen 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) af temperatur mellem 300 K og 600 K er beskrevet ved ligningen · ln · FOR GYNDSKOLELÆRERE, PÆDAGOGISKE UNIVERSITETSSTUDENTER OG SKOLEBØRN I 9.-10. klassetrin, DER BESLUTTEDE AT HÆNTE SIG TIL KEMI OG NATURFUNDSKAB
LÆREBOG
PROBLEMARBEJDER
LABORATORIEPRAKTIK
VIDENSKABELIGE HISTORIER AT LÆSE
I denne lærebog forsøger vi ikke at give færdige formler, men at udlede dem ved hjælp af de simpleste metoder inden for matematisk logik, så udledningen af denne formel er givet nedenfor. Efter at have læst dette materiale vil du blive fortrolig med de enkleste begreber sandsynlighedsteori, aktiveringsentropi osv.
Det er ikke kun aktiveringsenergien, der bestemmer hastigheden af en kemisk reaktion. Størrelsen og formen af de reagerende molekyler og placeringen af reaktive atomer eller deres grupper i dem spiller en enorm rolle. I denne henseende, når to partikler kolliderer, er deres specifikke orientering vigtig, dvs. kontakten mellem netop de centre, der er reaktive.
Lad os betegne sandsynligheden for den molekylære orientering, der kræves for interaktion under en kollision med W:
Den naturlige logaritme af værdien W ganget med gaskonstanten R kaldes aktiveringsentropien Sa:
![]()
Af dette udtryk følger:
![]()
Hvorfra, ved definitionen af logaritmen, får vi sandsynligheden for den krævede orientering:
Jo større sandsynligheden er for den nødvendige orientering for reaktionen, desto højere er dens hastighed og følgelig hastighedskonstanten, som kan skrives:
Tidligere har vi lært, at hastighedskonstanten afhænger af aktiveringsenergien og temperaturen:
Hastighedskonstanten afhænger således af aktiveringsenergien, temperaturen og aktiveringsentropien:
![]()
Lad os introducere proportionalitetskoefficienten Z og sætte et lighedstegn:
Det resulterende udtryk kaldes grundlæggende ligning for kemisk kinetik.
Denne ligning forklarer nogle aspekter af katalyse: en katalysator sænker aktiveringsenergien af en reaktion og øger entropien af aktivering, dvs. den øger sandsynligheden for den passende orientering af de reagerende partikler til interaktion.
Det er interessant at bemærke, at aktiveringsentropi ikke kun tager højde for partiklernes specifikke orientering, men også varigheden af kontakt i kollisionsøjeblikket. Hvis varigheden af kontakt mellem partikler er meget kort, så har deres elektrontætheder ikke tid til at omfordele for at danne nye kemiske bindinger, og partiklerne, frastødende, divergerer i forskellige retninger. Katalysatoren øger også signifikant varigheden af kontakt mellem de reagerende partikler.
Et andet træk ved den katalytiske virkning: Katalysatoren tager overskydende energi fra den nydannede partikel, og den opløses ikke i de oprindelige partikler på grund af dens høje energiaktivitet.
Du ved, at ligevægtskonstanten er forholdet mellem hastighedskonstanterne for de fremadrettede og omvendte reaktioner:
![]()
Lad os erstatte hastighedskonstanterne for de fremadrettede og omvendte reaktioner med udtryk for den grundlæggende ligning for kemisk kinetik:

Forholdet mellem to proportionalitetskoefficienter Z pr / Z arr er en konstant værdi, som vi vil lægge til værdien af ligevægtskonstanten, hvorfor den vil forblive konstant som før.
Hvis du husker reglerne for at arbejde med eksponentielle funktioner, vil du forstå transformationen af formlen:
I overensstemmelse med Hess' lov er forskellen mellem aktiveringsenergierne for de omvendte og fremadrettede reaktioner ændringen i entalpien (sørg for dette ved at tegne et entalpidiagram over reaktionen, der finder sted med frigivelsen af varme, og ikke at forglemme at i denne sag D N< 0 ):
![]()
Præcis samme forskel ![]() lad os betegne D S:
lad os betegne D S:
![]()
Forklar hvorfor der er et minustegn foran parentesen.
Vi får ligningen:
Lad os tage logaritmer af begge sider af denne ligning:
Hvor får vi:
Denne ligning er så vigtig for kemi og andre videnskaber, at mange oversøiske kemistuderende bærer skjorter med denne formel på.
Hvis D G er udtrykt i J/mol, så har formlen formlen:
Denne formel har én egenskab: hvis ligevægtskonstanten bestemmes gennem trykket af gasformige stoffer, så erstattes trykket af disse stoffer i atmosfæren i udtrykket af ligevægtskonstanten (1 atm = 101325 Pa = 760 mm Hg).
Denne formel tillader, givet en kendt værdi, D G reaktion, beregne ligevægtskonstanten og dermed finde ud af ligevægtssystemets sammensætning ved en given temperatur. Formlen viser, at jo højere ligevægtskonstanten og jo flere reaktionsprodukter (stoffer på højre side af reaktionsligningen) der er indeholdt i ligevægtsreaktionsblandingen, jo mere negativ er ændringen i reaktionens isobariske potentiale. Og omvendt, jo lavere værdien af ligevægtskonstanten og jo færre reaktionsprodukter og flere udgangsstoffer i ligevægtsblandingen, jo mindre er den negative værdi D G.
Når ligevægtskonstanten er større end 1, og det isobariske potentiale er negativt, er det sædvanligt at sige, at ligevægten forskydes mod reaktionsprodukterne eller til højre. Når ligevægtskonstanten er mindre end 1, og det isobariske potentiale er positivt, er det sædvanligt at sige, at ligevægten forskydes mod udgangsstofferne, eller til venstre.
Når ligevægtskonstanten er lig med 1, er det isobariske potentiale lig med 0. Denne tilstand af systemet anses for at være grænsen mellem ligevægtsskiftet til højre eller venstre. Når for en given reaktion er ændringen i isobarisk potentiale negativ ( D G<0 ), er det sædvanligt at sige, at reaktionen kan forløbe i fremadgående retning; Hvis D G>0, siger de, at reaktionen ikke forsvinder.
Således,
D G<0 – reaktionen kan finde sted (termodynamisk mulig);
D G<0 , Det K>1– balancen flyttes mod produkter til højre;
D G>0, Det TIL<1 – ligevægten forskydes mod udgangsstofferne, til venstre.
Hvis du har brug for at finde ud af, om den reaktion, du er interesseret i, er mulig (f.eks. for at finde ud af, om syntesen af det ønskede farvestof er mulig, om en given mineralsammensætning vil sintre, virkningen af atmosfærisk ilt på farven osv. ), er det nok at beregne for denne reaktion D G. Hvis ændringen i isobarisk potentiale viser sig at være negativ, så er reaktionen mulig, og man kan blande forskellige udgangsmaterialer for at opnå det ønskede produkt.
Læs hvad du skal gøre for at beregne ændringen i isobarisk potentiale og ligevægtskonstanten ved forskellige temperaturer (beregningsalgoritme).
1. Skriv ned fra referencetabellerne værdierne (for en temperatur på 298 K) af dannelsesentalpierne fra simple stoffer D N arr. og entropi S alle stoffer skrevet i ligningen for en kemisk reaktion. Hvis D N arr. er udtrykt i kJ/mol, så skal de omregnes til J/mol (hvorfor?).
2. Beregn entalpiændringen i reaktionen (298 K) som forskellen mellem summen af produkternes dannelsesentalpier og summen af dannelsesentalpierne af udgangsstofferne, idet du husker de støkiometriske koefficienter:
3. Beregn ændringen i entropi i reaktionen (298 K) som forskellen mellem summen af produkternes entropier og summen af entropierne af udgangsstofferne, idet du husker de støkiometriske koefficienter:
4. Lav en ligning for afhængigheden af ændringen i det isobariske potentiale af ændringer i reaktionens entalpi, entropi og temperatur, ved at erstatte de numeriske værdier lige opnået i den ligning, du kender D N r-tion Og D S distrikter:
5. Beregn ændringen i isobarisk potentiale ved en standardtemperatur på 298 K:
6. Ved tegn D G distrikter, 298 drag en konklusion om muligheden for, at reaktionen finder sted ved en standardtemperatur: hvis tegnet er "minus", er reaktionen termodynamisk mulig; hvis tegnet er "plus", så er reaktionen umulig.
7. Gør det regnestykke D G distrikter ved temperaturen T du er interesseret i:
og drag en konklusion om, hvordan en temperaturændring påvirker muligheden for en reaktion. Hvis det viser sig, at ved denne temperatur er ændringen i det isobariske potentiale blevet mindre positiv eller mere negativ i forhold til D G 298, så bliver reaktionen derfor mere sandsynlig ved denne temperatur.
8. Beregn ligevægtskonstanten K ud fra den ligning du kender ved den temperatur T du er interesseret i:
9. Træk en konklusion om skiftet i ligevægt mod udgangsstofferne (K<1) или в сторону продуктов (К>1).
For at konkludere om muligheden for, at en reaktion opstår med en negativ ændring i isobarisk potentiale ( D G distrikter<0 ) termodynamiske data alene er ofte utilstrækkelige. En termodynamisk mulig reaktion kan vise sig at være kinetisk hæmmet og mulig, når betingelserne ændrer sig (koncentration af stoffer, tryk, temperatur), gennem andre reaktionsveje eller i nærværelse af en korrekt valgt katalysator.
Lad os overveje eksemplet på reaktionen af krystallinsk jern med gasformigt vand (vanddamp):
Sådan finder du ud af den termodynamiske mulighed for en reaktion.
Denne reaktion er interessant, fordi den viser årsagerne til faldet i glansen af et metalprodukt og dets ødelæggelse fra korrosion.
Først og fremmest vælger vi de støkiometriske koefficienter for reaktionsligningen:
Lad os nedskrive de termodynamiske data (temperatur 298 K) for alle deltagere i reaktionen fra referencetabellerne:

Lad os beregne ændringen i entalpi i denne reaktion, idet vi husker, at entalpierne af simple stoffer er lig med nul:

Lad os udtrykke ændringen i entalpi i J:
Reaktionen ledsages af frigivelse af varme, Q>0, Q=+50 300 J/mol, og det gør det muligt at antage, at det sker spontant. Men vi kan med sikkerhed sige, at reaktionen kun er spontan ved tegnet på ændringen i det isobariske potentiale.
Lad os beregne ændringen i entropi i denne reaktion, ikke at glemme de støkiometriske koefficienter:

Systemets entropi aftager som følge af reaktionen, så det kan bemærkes, at der sker en stigning i orden i systemet.
Lad os nu oprette en ligning for afhængigheden af ændringer i isobarisk potentiale på ændringer i entalpi, entropi og temperatur:
Lad os beregne ændringen i det isobariske potentiale i reaktionen ved en standardtemperatur på 298 K:
En høj negativ værdi af ændringen i isobarisk potentiale indikerer, at jern ved stuetemperatur kan oxideres af oxygen. Hvis du kunne få det fineste jernpulver, ville du se, hvordan jern brænder i luften. Hvorfor brænder jernprodukter, figurer, søm osv. ikke i luften? Beregningsresultaterne viser, at jern korroderer i luft, dvs. det ødelægges og bliver til jernoxider.
Lad os nu se, hvordan stigende temperatur påvirker muligheden for denne reaktion. Lad os beregne ændringen i isobarisk potentiale ved en temperatur på 500 K:
Vi opnåede et resultat, der viser, at når temperaturen stiger, bliver ændringen i reaktionens isobariske potentiale mindre negativ. Det betyder, at med stigende temperatur bliver reaktionen mindre termodynamisk sandsynlig, dvs. ligevægten i reaktionen forskydes mere og mere mod udgangsstofferne.
Det er interessant at vide, ved hvilken temperatur ligevægten er ligeligt forskudt mod både reaktionsprodukterne og udgangsmaterialerne. Dette sker når D G r-tion =0(ligevægtskonstanten er 1):
Hvor får vi det fra:
T=150300/168,2=894K, eller 621°C.
Ved denne temperatur er det lige sandsynligt, at reaktionen finder sted i både fremadgående og tilbagegående retning. Ved temperaturer over 621°C begynder den omvendte reaktion af reduktion af Fe3O4 med hydrogen at dominere. Denne reaktion er en af måderne til at opnå rent jern (i metallurgi reduceres jernoxider med kulstof).
Ved en temperatur på 298 K:



Således, når temperaturen stiger, falder ligevægtskonstanten.
Jernoxid Fe 3 O 4 kaldes magnetit (magnetisk jernmalm). Dette jernoxid, i modsætning til oxiderne FeO (wüstit) og Fe 2 O 3 (hæmatit), tiltrækkes af en magnet. Der er et sagn om, at en hyrde ved navn Magnus i oldtiden fandt en meget lille aflang sten, som han lagde på vandoverfladen i en skål med sine fede (hvorfor er det vigtigt?) hænder. Småstenen druknede ikke og begyndte at flyde på vandet, og uanset hvordan hyrden vendte skålen, pegede stenen altid kun i én retning. Som om det var sådan kompasset blev opfundet, og mineralet fik sit navn fra navnet på denne hyrde. Selvom magnetit måske blev opkaldt efter den gamle by Lilleasien - Magnesia. Magnetit er den vigtigste malm, hvorfra jern udvindes.
Nogle gange er magnetitformlen afbildet som følger: FeO Fe 2 O 3, hvilket antyder, at magnetit består af to jernoxider. Dette er forkert: magnetit er et individuelt stof.
Et andet oxid af Fe 2 O 3 (hæmatit) - rød jernmalm - er så navngivet på grund af dets røde farve (i oversættelse fra græsk - blod). Jern fås fra hæmatit.
FeO-oxid findes næsten aldrig i naturen og har ingen industriel betydning.
En kvantitativ karakteristik, der viser retningen af en reaktion og ændringen i koncentrationen af stoffer, kaldes ligevægtskonstanten for en kemisk reaktion. Ligevægtskonstanten afhænger af temperaturen og arten af reagenserne.
Reversible og irreversible reaktioner
Alle reaktioner kan opdeles i to typer:
- reversibel, der samtidig flyder i to indbyrdes modsatte retninger;
- irreversible, der flyder i én retning med fuldstændigt forbrug af mindst ét udgangsstof.
Irreversible reaktioner producerer normalt uopløselige stoffer i form af et bundfald eller gas. Sådanne reaktioner omfatter:
- forbrænding:
C2H5OH + 3O2 → 2CO2 + H2O;
- nedbrydning:
2KMnO4 → K2MnO4 + Mn02 + H20;
- forbindelse med dannelsen af sediment eller gas:
BaCl 2 + Na 2 SO 4 → BaSO 4 ↓ + 2 NaCl.

Ris. 1. Dannelse af BaS04-præcipitat.
Reversible reaktioner er kun mulige under visse konstante betingelser. De oprindelige stoffer giver anledning til et nyt stof, som straks nedbrydes i dets bestanddele og samles igen. For eksempel, som et resultat af reaktionen 2NO + O 2 ↔ 2NO 2, nedbrydes nitrogenoxid (IV) let til nitrogenoxid (II) og oxygen.
Ligevægt
Efter en vis tid aftager hastigheden af en reversibel reaktion. Kemisk ligevægt opnås - en tilstand, hvor der ikke er nogen ændring i koncentrationen af udgangsstofferne og reaktionsprodukterne over tid, da hastighederne for de fremadrettede og omvendte reaktioner udlignes. Ligevægt er kun mulig i homogene systemer, det vil sige, at alle reagerende stoffer er enten væsker eller gasser.
Lad os overveje kemisk ligevægt ved at bruge eksemplet på reaktionen mellem hydrogen og jod:
- direkte reaktion -
H2 + I2 ↔ 2HI;
- tilbageslag -
2HI ↔ H2 + I2.
Så snart to reagenser er blandet - brint og jod - eksisterer hydrogeniodid endnu ikke, da simple stoffer kun reagerer. Et stort antal udgangsstoffer reagerer aktivt med hinanden, så hastigheden af den direkte reaktion vil være maksimal. I dette tilfælde forekommer den omvendte reaktion ikke, og dens hastighed er nul.
Hastigheden af den fremadrettede reaktion kan udtrykkes grafisk:
ν pr = k pr ∙ ∙ ,
hvor k pr er hastighedskonstanten for den direkte reaktion.
Over tid forbruges reagenserne, og deres koncentration falder. Følgelig falder hastigheden af den fremadrettede reaktion. Samtidig stiger koncentrationen af et nyt stof, hydrogeniodid. Når den er akkumuleret, begynder den at nedbrydes, og hastigheden af den omvendte reaktion stiger. Det kan udtrykkes som
ν arr = k arr ∙ 2.
Hydrogeniodid i kvadrat, da koefficienten for molekylet er to.
På et vist tidspunkt bliver hastighederne for de fremadrettede og omvendte reaktioner lige store. Der opstår en tilstand af kemisk ligevægt.

Ris. 2. Graf over reaktionshastighed versus tid.
Ligevægten kan forskydes enten mod udgangsmaterialerne eller mod reaktionsprodukterne. Forskydning på grund af eksterne faktorer kaldes Le Chateliers princip. Ligevægten påvirkes af temperatur, tryk og koncentrationen af et af stofferne.
Konstant beregning
I en ligevægtstilstand opstår begge reaktioner, men samtidig er koncentrationerne af stoffer i ligevægt (der dannes ligevægtskoncentrationer), da hastighederne er afbalancerede (ν pr = ν arr).
Kemisk ligevægt er kendetegnet ved en kemisk ligevægtskonstant, som udtrykkes ved den sammenfattende formel:
K p = k pr / k arr = konst.
Reaktionshastighedskonstanter kan udtrykkes i forhold til reaktionshastighedsforholdet. Lad os tage den betingede ligning for den omvendte reaktion:
aA + bB ↔ cC + dD.
Så vil hastighederne for fremadgående og omvendte reaktioner være ens:
- ν pr = k pr ∙ [A] p a ∙ [B] p b
- ν arr = k arr ∙ [C] p c ∙ [D] p d .
Følgelig, hvis
ν pr = ν arr,
k pr ∙ [A] p a ∙ [B] p b = k arr ∙ [C] p c ∙ [D] p d .
Herfra kan vi udtrykke forholdet mellem konstanter:
k arr / k pr = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .
Dette forhold er lig med ligevægtskonstanten:
K p = [C] p c ∙ [D] p d / [A] p a ∙ [B] p b .

Ris. 3. Formel for ligevægtskonstanten.
Værdien viser, hvor mange gange hastigheden af den fremadrettede reaktion er større end hastigheden af den omvendte reaktion.
Hvad har vi lært?
Afhængigt af slutprodukterne klassificeres reaktioner i reversible og irreversible. Reversible reaktioner forløber i begge retninger: Udgangsstoffer danner slutprodukter, som nedbrydes til udgangsstoffer. Under reaktionen afbalanceres hastighederne af de fremadrettede og omvendte reaktioner. Denne tilstand kaldes kemisk ligevægt. Det kan udtrykkes som forholdet mellem produktet af ligevægtskoncentrationerne af reaktionsprodukterne og produktet af ligevægtskoncentrationerne af udgangsstofferne.
Test om emnet
Evaluering af rapporten
Gennemsnitlig bedømmelse: 4.8. Samlede vurderinger modtaget: 64.
I nogle tilfælde er det nødvendigt at kende ikke kun retningen af redoxreaktionen, men også hvor fuldstændig den forløber. For eksempel kan du i kvantitativ analyse kun stole på de reaktioner, der praktisk talt fortsætter 100% (eller er tæt på det).
I hvilken grad en reaktion forløber fra venstre mod højre, bestemmes af ligevægtskonstanten. Til reaktion
Ifølge loven om massehandling kan vi skrive:
![]()
hvor K er ligevægtskonstanten, der viser, hvad der er sammenhængen mellem koncentrationerne af ioner og ved ligevægt.
Ligevægtskonstanten bestemmes som følger. I ligning (3) (s. 152) erstatter værdierne af parrenes normale potentialer og find:

Ved ligevægt = eller


Ligevægtskonstanten viser, at zink fortrænger kobberioner fra opløsningen, indtil koncentrationen af ioner i opløsningen bliver en gang mindre end koncentrationen af ioner. Det betyder, at den pågældende reaktion er næsten afsluttet.
Hvis fx koncentrationen i begyndelsen af reaktionen er 0,1 m, så vil den ved ligevægt være 0,1 - x mens koncentrationen vil være x.
Løsning af ligningen er koncentrationen ved ligevægt meget tæt på 0,1 m.
Men hvis vi kunne ændre forholdet mellem interagerende komponenter, så det bliver , dvs. eller så ville reaktionen gå fra højre mod venstre (dvs. i den modsatte retning).
Ligevægtskonstanten for enhver redoxproces kan beregnes, hvis redoxpotentialerne for bestemte reaktioner er kendte.
Ligevægtskonstanten er relateret til redoxpotentialer med den generelle formel:

hvor K er reaktionsligevægtskonstanten; og normale potentialer (oxidationsmiddel og reduktionsmiddel); n er ladningen af ioner (antallet af elektroner, der afgives af reduktionsmidlet og accepteres af oxidationsmidlet).
Ud fra formel (4) finder vi ligevægtskonstanten:

Ved at kende ligevægtskonstanten er det muligt uden at ty til eksperimentelle data at beregne, hvor fuldstændig reaktionen forløber.
Altså for eksempel i reaktionen
for et par = -0,126 V, for et par = -0,136 V.
Når disse data indsættes i ligning (4), finder vi:
![]()
Tallet 2,21 betyder, at der opstår ligevægt i den pågældende reaktion, når ionkoncentrationen bliver 2,21 gange mindre end ionkoncentrationen.
Ionkoncentrationen ved ligevægt er 2,21 gange ionkoncentrationen. Derfor er der 1 gram ion for hver 2,21 gram ioner. I alt indeholder opløsningen 3,21 gram ioner (2,21 + 1). For hver 3,21 gram ioner i opløsning er der således 2,21 gram ioner, og for 100 dele vil der være x dele.

Derfor forløber denne reaktion reversibelt. Lad os beregne ligevægtskonstanten for reaktionen:
Potentiale for et par = 1,51 V, potentiale for et par = 0,77 V. Ved at erstatte disse potentielle værdier i ligning (4), finder vi:

Denne konstant viser, at der opstår ligevægt, når produktet af koncentrationerne af ioner i tælleren (dannet under reaktionen) bliver gange større end produktet af koncentrationerne af nævnerionerne (reagerer).
Det er klart, at denne reaktion forløber næsten irreversibelt (dvs. 100 % fra venstre mod højre).
Til reaktion
En beregning (svarende til ovenstående) viser, at denne reaktion sker ved .
Ligevægten ændrer sig afhængigt af reaktionsbetingelserne.
Mediets reaktion har en exceptionel indflydelse på værdien af konstanten. For eksempel forløber reaktionen af reduktion af arsensyre med iodion i et surt medium ifølge ligningen:
Reduktionspotentialet for arsensyre i et alkalisk miljø er meget lavere. Derfor foregår den omvendte proces i et alkalisk miljø:
I et neutralt miljø kan begge processer repræsenteres som følger:

det vil de dog ikke.
Processen ifølge den første ligning vil ikke fungere, fordi den er forbundet med ophobning af ioner, som leder processen i den modsatte retning; kun når der skabes et surt miljø, der neutraliserer hydroxidioner, vil det bevæge sig fra venstre mod højre.
Ifølge den anden ligning vil processen ikke fungere, fordi den er forbundet med ophobning af ioner, som skal neutraliseres med alkali, hvis reaktionen skal forløbe fra venstre mod højre.
Der er følgende regel for at skabe det reaktionsmiljø, der er nødvendigt for optimalt procesflow:
Hvis brint- eller hydroxidioner akkumuleres som et resultat af en redoxreaktion, er det for det ønskede forløb af processen nødvendigt at skabe et miljø, der har modsatte egenskaber: i tilfælde af akkumulering af ioner skal miljøet være alkalisk, men i i tilfælde af ophobning af ioner skal miljøet være surt.
Til reaktionen skal du tage komponenter, der kræver det samme miljø (syre eller basisk). Hvis et stof i en reaktion er et reduktionsmiddel i et surt miljø, og det andet er et oxidationsmiddel i et alkalisk miljø, så kan processen hæmmes; i dette tilfælde vil processen kun nå fuldendelse med en stor potentialforskel, dvs. med en høj reaktionskonstant.
Ligevægtskonstanten giver mulighed for at forudsige muligheden for oxidation, for eksempel med salpetersyre.
Lad os finde ligevægtskonstanten for opløsningsreaktionen i . opløses godt i fortyndet. Ligevægtskonstant for reaktionen:
kan beregnes ud fra ligningen:
En sådan lille værdi af konstanten indikerer, at ligevægten af denne reaktion er næsten fuldstændig forskudt fra højre til venstre, dvs. kviksølvsulfid er i modsætning til kobbersulfid praktisk talt uopløseligt i fortyndet opløsning.














