İdeal gaz basıncının sıcaklığa bağlılığı. Sabit basınçta belirli bir gaz kütlesinin hacmi mutlak sıcaklıkla orantılıdır. Birleşik Devlet Sınavı kodlayıcısının konuları: izoprosesler - izotermal, izokorik, izobarik süreçler
giriiş
İdeal bir gazın durumu tamamen ölçülebilir büyüklüklerle tanımlanır: basınç, sıcaklık, hacim. Bu üç büyüklük arasındaki ilişki temel gaz yasasıyla belirlenir:
İşin amacı
Boyle-Mariotte yasasını kontrol ediyorum.
Çözülmesi gereken sorunlar
Gaz sıcaklığının sabit olduğu dikkate alınarak hacim değiştiğinde şırıngadaki hava basıncının ölçülmesi.
Deneysel kurulum
Cihazlar ve aksesuarlar
Basınç ölçer
Manuel vakum pompası
Bu deneyde Boyle-Mariotte yasası, Şekil 1'de gösterilen düzen kullanılarak doğrulanır. Şırıngadaki havanın hacmi şu şekilde belirlenir:
burada p 0 atmosferik basınç, аp – basınç göstergesi kullanılarak ölçülen basınç.
İş emri
Şırınga pistonunu 50 ml işaretine ayarlayın.
Kılavuzun bağlantı hortumunun serbest ucunu itin vakum pompasışırınganın çıkışına.
Pistonu uzatırken hacmi 5 ml'lik artışlarla artırın ve manometre okumalarını siyah skalaya kaydedin.
Pistonun altındaki basıncı belirlemek için, paskal cinsinden ifade edilen monometre okumalarını atmosferik basınçtan çıkarmak gerekir. Atmosfer basıncı yaklaşık 1 bar'a eşittir, bu da 100.000 Pa'ya karşılık gelir.
Ölçüm sonuçlarını işlemek için bağlantı hortumunda hava varlığı dikkate alınmalıdır. Bunu yapmak için, duvar kalınlığının 1,5 mm olduğunu dikkate alarak hortumun uzunluğunu bir mezura ile ve hortumun çapını bir kumpasla ölçerek bağlantı hortumunun hacmini ölçün ve hesaplayın.
Ölçülen hava hacminin basınca karşı grafiğini çizin.
Boyle-Mariotte yasasını kullanarak sabit sıcaklıkta hacmin basınca bağımlılığını hesaplayın ve bir grafik çizin.
Teorik ve deneysel bağımlılıkları karşılaştırın.
2133. Sabit hacimde gaz basıncının sıcaklığa bağımlılığı (Charles yasası)
giriiş
Belirli bir gaz kütlesinin hacminin sabit kalması koşuluyla, gaz basıncının sıcaklığa bağlı olduğunu düşünelim. Bu çalışmalar ilk kez 1787 yılında Jacques Alexandre Cesar Charles (1746-1823) tarafından gerçekleştirilmiştir. Gaz, dar kavisli bir tüp şeklinde bir cıva manometresine bağlı büyük bir şişede ısıtıldı. Isıtıldığında şişenin hacmindeki önemsiz artış ve cıva dar bir manometrik tüp içinde yer değiştirdiğinde hacimdeki önemsiz değişiklik ihmal edilir. Bu nedenle gazın hacmi sabit kabul edilebilir. Şişeyi çevreleyen bir kapta su ısıtılarak gazın sıcaklığı bir termometre kullanılarak ölçüldü. T ve karşılık gelen basınç R- manometreye göre. Kabı eriyen buzla doldurarak basınç belirlendi R Ö ve karşılık gelen sıcaklık T Ö. 0 C'de basıncın olduğu bulundu. R Ö , daha sonra 1 C ısıtıldığında basınç artışı şu şekilde olacaktır: R Ö. miktarı tüm gazlar için aynı değere (daha kesin olarak hemen hemen aynı) sahiptir, yani 1/273 C -1. miktarına sıcaklık basıncı katsayısı denir.

Charles yasası, 0 C sıcaklıktaki basıncı biliniyorsa, herhangi bir sıcaklıkta bir gazın basıncını hesaplamanıza izin verir. Belirli bir hacimde 0 C'de belirli bir gaz kütlesinin basıncı olsun P Ö ve aynı gazın sıcaklıktaki basıncı TP. Sıcaklık değişir T ve basınç şu şekilde değişir: R Ö T, daha sonra basınç R eşittir:
çok Düşük sıcaklık Gaz sıvılaşma durumuna yaklaştığında ve yüksek oranda sıkıştırılmış gazlarda Charles yasası geçerli değildir. Charles kanunu ile Gay-Lussac kanununda yer alan ve katsayılarının çakışması tesadüfi değildir. Sabit sıcaklıkta gazlar Boyle-Mariotte kanununa uyduğu için ve birbirine eşit olmalıdır.
Basıncın sıcaklık katsayısı değerini, basıncın sıcaklığa bağlılığı formülüne koyalım:
|
|
Değer ( 273+ T) birimi Celsius ölçeğiyle aynı olan yeni bir sıcaklık ölçeğinde ölçülen sıcaklık değeri olarak düşünülebilir ve sıfır, Celsius'un sıfırı olarak alınan noktanın 273 altında bulunan bir nokta olarak alınır. ölçek, yani buzun erime noktası. Bu yeni ölçeğin sıfırına mutlak sıfır denir. Bu yeni ölçeğe termodinamik sıcaklık ölçeği adı verilmektedir. T T+273 .
O halde sabit hacimde Charles yasası geçerlidir:
|
|
İşin amacı
Charles Yasasını Test Etmek
Çözülmesi gereken sorunlar
Sabit hacimde gaz basıncının sıcaklığa bağımlılığının belirlenmesi
Düşük sıcaklıklara doğru ekstrapolasyon yoluyla mutlak sıcaklık ölçeğinin belirlenmesi
Güvenlik önlemleri
Dikkat: Bu çalışmada cam kullanılmıştır.
Gaz termometresiyle çalışırken son derece dikkatli olun; cam kap ve ölçüm kabı.
Sıcak su ile çalışırken son derece dikkatli olun.
Deneysel kurulum
Cihazlar ve aksesuarlar
Gaz termometresi
Mobil CASSY Laboratuvarı
Termokupl
Elektrikli ısıtma plakası
Cam ölçüm kabı
Cam kap
Manuel vakum pompası
kullanarak oda sıcaklığında hava pompalarken el pompasıр0+р hava sütununda basınç oluşturulur, burada R 0 – dış basınç. Bir damla cıva da hava sütununa baskı uygular:
Bu deneyde bu yasa bir gaz termometresi kullanılarak doğrulanmıştır. Termometre yaklaşık 90°C sıcaklıktaki suya yerleştirilir ve bu sistem kademeli olarak soğutulur. Havayı dışarı pompalamak gaz termometresi manuel bir vakum pompası kullanarak, destek sabit hacim Soğutma sırasında hava.
|
|
İş emri
Gaz termometresinin kapağını açın, el tipi vakum pompasını termometreye bağlayın.
Termometreyi Şekil 2'de solda gösterildiği gibi dikkatlice çevirin. 2 ve bir pompa kullanarak havayı dışarı pompalayın, böylece bir damla cıva a) noktasına ulaşacaktır (bkz. Şekil 2).
a) noktasında bir damla cıva toplandıktan sonra, termometreyi deliği yukarı bakacak şekilde çevirin ve cıvanın birkaç damlacığa ayrılmaması için pompadaki b) kolundan (bkz. Şekil 2) basınçlı havayı dikkatlice boşaltın.
Suyu bir cam kapta ocak üzerinde 90°C'ye ısıtın.
Dökün sıcak su bir cam kabın içine.
Kabın içine bir gaz termometresi yerleştirin ve bir tripod üzerine sabitleyin.
Termokupl suya yerleştirin, sistem yavaş yavaş soğur. Elde taşınan bir vakum pompası kullanarak gaz termometresinden hava pompalayarak, soğutma işlemi boyunca sabit bir hava sütunu hacmi sağlarsınız.
Manometre okumasını kaydedin R ve sıcaklık T.
Toplam gaz basıncının bağımlılığını çizin P 0 +P+P Hg o C cinsinden sıcaklıktan.
Grafiğe x eksenini kesinceye kadar devam edin. Kesişme sıcaklığını belirleyin ve elde edilen sonuçları açıklayın.
Eğim açısının tanjantını kullanarak şunu belirleyin: sıcaklık katsayısı basınç.
Sabit hacimde basıncın sıcaklığa bağımlılığını Charles yasasını kullanarak hesaplayın ve bir grafik çizin. Teorik ve deneysel bağımlılıkları karşılaştırın.
Basınç, sıcaklık, hacim ve gazın mol sayısı (gazın “kütlesi”) arasındaki ilişki. Evrensel (molar) gaz sabiti R. Clayperon-Mendeleev denklemi = ideal bir gazın durum denklemi.
|
Pratik uygulanabilirliğin sınırlamaları:
Bu aralık dahilinde denklemin doğruluğu, geleneksel modern mühendislik ölçüm cihazlarının doğruluğunu aşıyor. Mühendisin, sıcaklık arttıkça tüm gazlar için önemli ayrışma veya ayrışmanın mümkün olduğunu anlaması önemlidir. |
|
|
|
Yukarıdaki gazların çoğu için geçerli olan, gazın bileşiminin değişmediği (gazın ayrışmadığı) varsayımıyla gazın hacimsel ve kütlesel akış hızlarıyla ilgili birkaç problemi çözelim.
Bu görev gaz hacminin doğrudan ölçüldüğü uygulamalar ve cihazlar için geçerlidir, ancak yalnızca bunlarla sınırlı değildir.
V1 Ve V2 sıcaklıklarda sırasıyla, T1 Ve T2 bırak gitsin T1< T2. O zaman şunu biliyoruz:
Doğal olarak, V1< V2
- Sıcaklık ne kadar düşük olursa, hacimsel gaz sayacının göstergeleri o kadar anlamlı olur.
- “sıcak” gaz tedarik etmek karlı
- “soğuk” gaz satın almak karlı
Bununla nasıl başa çıkılır? En azından basit bir sıcaklık kompanzasyonu gereklidir, yani sayma cihazına ek bir sıcaklık sensöründen gelen bilgiler sağlanmalıdır.
Bu görev esas olarak gaz hızının doğrudan ölçüldüğü uygulamalar ve cihazlar için geçerlidir, ancak yalnızca bunlarla sınırlı değildir.
Teslimat noktasındaki counter()'ın hacimsel birikmiş maliyetleri vermesine izin verin V1 Ve V2, sırasıyla basınçlarda, P1 Ve P2 bırak gitsin P1< P2. O zaman şunu biliyoruz:
Doğal olarak, V1>V2 Belirli koşullar altında aynı miktarda gaz için. Bu durum için birkaç pratik sonuç çıkarmaya çalışalım:
- Basınç ne kadar yüksek olursa, gaz hacmi ölçerin göstergeleri de o kadar anlamlı olur.
- gaz tedarik etmek karlı alçak basınç
- yüksek basınçlı gaz satın almak karlı
Bununla nasıl başa çıkılır? En azından basit bir basınç dengelemesi gereklidir, yani sayma cihazına ek bir basınç sensöründen gelen bilgiler sağlanmalıdır.
Sonuç olarak, teorik olarak her gaz sayacının hem sıcaklık kompanzasyonuna hem de basınç kompanzasyonuna sahip olması gerektiğini belirtmek isterim. Pratikte......
Dipnot: Konunun geleneksel sunumu, bilgisayar modeli üzerinde bir gösteri ile desteklenmiştir.
Maddenin toplam üç halinden en basit olanı gaz halidir. Gazlarda moleküller arasında etkili olan kuvvetler küçüktür ve belirli koşullar altında ihmal edilebilir.
Gaz denir mükemmel , Eğer:
Moleküllerin boyutları ihmal edilebilir, yani. moleküller maddi noktalar olarak düşünülebilir;
Moleküller arasındaki etkileşim kuvvetlerini ihmal edebiliriz ( potansiyel enerji moleküllerin etkileşimleri kinetik enerjilerinden çok daha azdır);
Moleküllerin birbirleriyle ve kabın duvarlarıyla çarpışmaları kesinlikle elastik kabul edilebilir.
Gerçek gazlar aşağıdaki durumlarda ideal gazların özelliklerine yakındır:
Normal koşullara yakın koşullar (t = 0 0 C, p = 1,03·10 5 Pa);
Yüksek sıcaklıklarda.
İdeal gazların davranışını yöneten yasalar oldukça uzun zaman önce deneysel olarak keşfedildi. Böylece Boyle-Mariotte yasası 17. yüzyılda kuruldu. Bu yasaların formülasyonlarını verelim.
Boyle Yasası - Mariotte. Gazın sıcaklığının sabit tutulduğu koşullarda olmasına izin verin (bu tür koşullara denir) izotermal ).Bu durumda belirli bir gaz kütlesi için basınç ve hacmin çarpımı sabittir:
Bu formül denir izoterm denklemi. Grafiksel olarak, çeşitli sıcaklıklar için p'nin V'ye bağımlılığı şekilde gösterilmiştir.

Bir cismin hacmi değiştiğinde basıncı değiştirme özelliğine denir sıkıştırılabilme. Hacim değişikliği T=sabitte meydana gelirse, sıkıştırılabilirlik karakterize edilir izotermal sıkıştırılabilirlik katsayısışu şekilde tanımlanır: göreceli değişim hacim, basınçta bir birim değişikliğe neden olur.

İdeal bir gaz için değerini hesaplamak kolaydır. İzoterm denkleminden şunu elde ederiz:

Eksi işareti hacim arttıkça basıncın azaldığını gösterir. Dolayısıyla ideal bir gazın izotermal sıkıştırılabilirlik katsayısı şuna eşittir: karşılıklı onun baskısı. Basınç arttıkça azalır çünkü Basınç ne kadar yüksek olursa, gazın daha fazla sıkıştırılma şansı o kadar az olur.
Gay-Lussac yasası. Gazın, basıncının sabit tutulduğu koşullarda olmasına izin verin (bu tür koşullara denir) izobarik ). Hareketli bir pistonla kapatılan bir silindire gaz yerleştirilerek elde edilebilirler. Daha sonra gaz sıcaklığındaki bir değişiklik pistonun hareketine ve hacimde bir değişikliğe yol açacaktır. Gaz basıncı sabit kalacaktır. Bu durumda, belirli bir gaz kütlesi için hacmi sıcaklıkla orantılı olacaktır:
![]()
burada V 0, t = 0 0 C sıcaklıktaki hacimdir, - hacimsel genleşme katsayısı gazlar Sıkıştırılabilirlik katsayısına benzer bir biçimde temsil edilebilir:

Grafiksel olarak V'nin T'ye bağımlılığı farklı baskılarşekilde gösterilmiştir.

Celsius cinsinden sıcaklıktan mutlak sıcaklığa geçerken Gay-Lussac yasası şu şekilde yazılabilir:
Charles'ın yasası. Bir gaz hacminin sabit kaldığı koşullarda ise ( izokorik koşullar), o zaman belirli bir gaz kütlesi için basınç sıcaklıkla orantılı olacaktır:
![]()
burada p 0 - t = 0 0 C sıcaklıktaki basınç, - basınç katsayısı. 1 0 dereceye kadar ısıtıldığında gaz basıncındaki bağıl artışı gösterir:

Charles yasası şu şekilde de yazılabilir:
Avogadro Yasası: Aynı sıcaklık ve basınçta herhangi bir ideal gazın bir molü aynı hacmi kaplar. Şu tarihte: normal koşullar(t = 0 0 C, p = 1,03·10 5 Pa) bu hacim m -3 /mol'e eşittir.
1 molün içerdiği parçacık sayısı çeşitli maddeler, isminde Avogadro sabiti :
Normal koşullar altında 1 m3 başına n0 parçacık sayısını hesaplamak kolaydır:

Bu numara denir Loschmidt numarası.
Dalton Yasası:İdeal gazlardan oluşan bir karışımın basıncı, içine giren gazların kısmi basınçlarının toplamına eşittir;
Nerede - kısmi basınçlar- Karışımın bileşenlerinin her birinin aynı sıcaklıkta karışımın hacmine eşit bir hacim işgal etmesi durumunda uygulayacağı basınç.
Clapeyron - Mendeleev denklemi. Elde edebileceğimiz ideal gaz yasalarından Devlet denklemi , denge durumunda ideal bir gazın T, p ve V'sini birbirine bağlar. Bu denklem ilk olarak Fransız fizikçi ve mühendis B. Clapeyron ile Rus bilim adamları D.I. Mendeleev bu nedenle onların adını taşıyor.
Belirli bir gaz kütlesinin V 1 hacmini işgal ettiğini, p 1 basıncına sahip olduğunu ve T 1 sıcaklığında olduğunu varsayalım. Farklı bir durumdaki aynı gaz kütlesi, V2, p2, T2 parametreleriyle karakterize edilir (şekle bakınız). Durum 1'den durum 2'ye geçiş iki süreç şeklinde gerçekleşir: izotermal (1 - 1") ve izokorik (1" - 2).

Bu süreçler için Boyle - Mariotte ve Gay - Lussac yasalarını yazabiliriz:
Denklemlerden p 1 "'i çıkararak şunu elde ederiz:
Durum 1 ve 2 keyfi olarak seçildiğinden son denklem şu şekilde yazılabilir:
![]()
Bu denklem denir Clapeyron denklemi burada B, farklı gaz kütleleri için farklı bir sabittir.
Mendeleev, Clapeyron denklemini Avogadro yasasıyla birleştirdi. Avogadro yasasına göre, aynı p ve T'ye sahip herhangi bir ideal gazın 1 molü aynı V m hacmini kaplar, dolayısıyla B sabiti tüm gazlar için aynı olacaktır. Tüm gazlar için ortak olan bu sabit R ile gösterilir ve denir. Evrensel gaz sabiti. Daha sonra
Bu denklem ideal gaz hal denklemi buna aynı zamanda denir Clapeyron-Mendeleev denklemi .
Evrensel gaz sabitinin sayısal değeri, normal koşullar altında p, T ve Vm değerlerinin Clapeyron-Mendeleev denklemine yerleştirilmesiyle belirlenebilir:
Clapeyron-Mendeleev denklemi herhangi bir gaz kütlesi için yazılabilir. Bunu yapmak için, m kütleli bir gazın hacminin bir molün hacmiyle V = (m/M)Vm formülüyle ilişkili olduğunu unutmayın; burada M, gazın molar kütlesi. O zaman m kütleli bir gaz için Clapeyron-Mendeleev denklemi şu şekilde olacaktır:
![]()
mol sayısı nerede.
Genellikle ideal bir gazın durum denklemi şu şekilde yazılır: Boltzmann sabiti :
![]()
Buna dayanarak durum denklemi şu şekilde temsil edilebilir:
![]()
moleküllerin konsantrasyonu nerede. Son denklemden ideal bir gazın basıncının, sıcaklığı ve molekül konsantrasyonuyla doğru orantılı olduğu açıktır.
Küçük gösteriİdeal gaz yasaları. Düğmeye bastıktan sonra "Başlayalım" Sunucunun ekranda olup bitenlerle ilgili yorumlarını (siyah renk) ve düğmeye bastıktan sonra bilgisayarın eylemlerinin açıklamasını göreceksiniz. "Daha öte" (kahverengi renk). Bilgisayar "meşgul" olduğunda (yani test devam ederken) bu düğme etkin değildir. Ancak mevcut deneyde elde edilen sonucu anladıktan sonra bir sonraki kareye geçin. (Algınız sunum yapan kişinin yorumlarıyla örtüşmüyorsa yazın!)
İdeal gaz yasalarının geçerliliğini mevcut
Kütlesi ve hacmi sabit kaldığında gaz basıncının sıcaklığa nasıl bağlı olduğunu düşünelim.
Gazla dolu kapalı bir kabı alıp ısıtalım (Şekil 4.2). Gaz sıcaklığını bir termometre kullanarak ve basıncı bir manometre M kullanarak belirleyeceğiz.


Öncelikle kabı eriyen kar içerisine yerleştirip gaz basıncını 0°C olarak belirleyeceğiz, ardından dış kabı kademeli olarak ısıtıp gaza ait değerleri kaydedeceğiz. Böyle bir deneyime dayanarak oluşturulan bağımlılık grafiğinin düz bir çizgiye benzediği ortaya çıktı (Şekil 4.3, a). Bu grafiği sola doğru devam ettirirsek sıfır gaz basıncına karşılık gelen A noktasında x ekseniyle kesişecektir.
Şekil 2'deki üçgenlerin benzerliğinden. 4.3, ancak şunu yazabilirsiniz:
Sabiti y ile gösterirsek, şunu elde ederiz:
![]()
Esasen, açıklanan deneylerdeki orantı katsayısı y, gaz basıncındaki değişimin türüne bağlılığını ifade etmelidir.
Sabit bir hacimde ve sabit bir gaz kütlesinde sıcaklık değişimi işlemi sırasında gaz basıncındaki değişimin türüne bağımlılığını karakterize eden miktara sıcaklık basınç katsayısı denir. Basınç sıcaklık katsayısı, 0 °C'de alınan bir gazın basıncının ne kadarının ısıtıldığında basıncının değiştiğini gösterir.
Sıcaklık katsayısı y'nin birimini SI cinsinden türetelim:
Açıklanan deneyin çeşitli gazlar için tekrarlanması çeşitli kitleler, deneysel hatalar dahilinde, tüm grafikler için A noktasının aynı yerde elde edildiği tespit edilebilir (Şekil 4.3, b). Bu durumda OA segmentinin uzunluğu eşittir. Dolayısıyla her durumda gaz basıncının sıfıra gitmesi gereken sıcaklık aynı ve eşittir ve basınç sıcaklık katsayısına dikkat edin. Kesin değer y eşittir Sorunları çözerken genellikle y'nin yaklaşık değerini kullanırlar:
Deneyler sonucunda y'nin değeri ilk kez 1787'de Fransız fizikçi J. Charles tarafından belirlendi. sonraki yasa: Basınç sıcaklık katsayısı gazın türüne bağlı değildir ve eşittir. Bunun yalnızca düşük yoğunluklu gazlar ve sıcaklıktaki küçük değişiklikler için geçerli olduğunu unutmayın; yüksek basınçlarda veya düşük sıcaklıklarda, y gazın türüne bağlıdır. Yalnızca ideal bir gaz Charles yasasına kesinlikle uyar.
Silindirlerdeki hava miktarı silindirin hacmine, hava basıncına ve sıcaklığına bağlıdır. Sabit sıcaklıkta hava basıncı ile hacmi arasındaki ilişki şu ilişkiyle belirlenir:
burada р1 ve р2 başlangıç ve son mutlak basınçtır, kgf/cm²;
V1 ve V2 - havanın başlangıç ve son hacmi, l. Sabit bir hacimde hava basıncı ile sıcaklığı arasındaki ilişki şu ilişkiyle belirlenir:
burada t1 ve t2 başlangıç ve son hava sıcaklıklarıdır.
Bu bağımlılıkları kullanarak hava solunum cihazının şarj edilmesi ve çalıştırılması sürecinde karşılaştığınız çeşitli sorunları çözebilirsiniz.
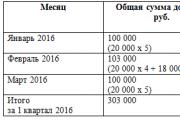
Örnek 4.1. Aparat silindirlerinin toplam kapasitesi 14 litre olup içlerindeki aşırı hava basıncı (manometreye göre) 200 kgf/cm²'dir. Hacmi belirle serbest hava yani hacim normal (atmosferik) koşullara düşürülür.
Çözüm. Başlangıç mutlak atmosferik hava basıncı p1 = 1 kgf/cm². Basınçlı havanın nihai mutlak basıncı p2 = 200 + 1 = 201 kgf/cm². Basınçlı havanın son hacmi V 2 = 14 l. (4.1)'e göre silindirlerdeki serbest hava hacmi
Örnek 4.2. Hava, 200 kgf/cm² basınç (mutlak basınç 201 kgf/cm²) ile 40 litre kapasiteli bir taşıma silindirinden, toplam kapasitesi 14 litre ve 30 kgf/cm² artık basınçla aparat silindirlerine aktarıldı. (mutlak basınç 31 kgf/cm²). Hava bypassından sonra silindirlerdeki hava basıncını belirleyin.
Çözüm.(4.1)'e göre taşıma ve ekipman silindirleri sistemindeki toplam serbest hava hacmi
Silindir sistemindeki toplam basınçlı hava hacmi
Hava bypassından sonra silindir sistemindeki mutlak basınç
aşırı basınç = 156 kgf/cm².
Bu örnek, aşağıdaki formül kullanılarak mutlak basınç hesaplanarak tek adımda çözülebilir.
Örnek 4.3.+17° C sıcaklıktaki bir odada aparat silindirlerindeki hava basıncını ölçerken manometre 200 kgf/cm² değerini gösterdi. Cihaz dışarı çıkarıldı ve birkaç saat sonra çalışma kontrolü sırasında manometrede 179 kgf/cm²'ye kadar bir basınç düşüşü tespit edildi. Dış hava sıcaklığı -13° C. Silindirlerden hava sızıntısı şüphesi var. Hesaplamaları kullanarak bu şüphenin geçerliliğini kontrol edin.
Çözüm. Silindirlerdeki başlangıçtaki mutlak hava basıncı p1 = 200 + 1 = 201 kgf/cm², nihai mutlak basınç p2 = 179 + 1 = 180 kgf/cm²'dir. Silindirlerdeki başlangıç hava sıcaklığı t1 = + 17° C, son sıcaklık t2 = - 13° C. Silindirlerdeki nihai mutlak hava basıncı (4.2)'ye göre hesaplanmıştır.
Gerçek ve hesaplanan basınçlar eşit olduğundan şüpheler yersizdir.
Örnek 4.4. Su altında bir denizaltı yüzücüsü, 40 m dalış derinliği basıncına kadar sıkıştırılmış 30 l/dak hava tüketir. Serbest hava tüketimini belirleyin, yani atmosferik basınca dönüştürün.
Çözüm. Başlangıçtaki (atmosferik) mutlak hava basıncı p1 = l kgf/cm². (1,2) р2 =1 + 0,1*40 = 5 kgf/cm²'ye göre basınçlı havanın nihai mutlak basıncı. Nihai basınçlı hava akışı V2 = 30 l/dak. (4.1)'e göre serbest hava akışı