Atomets elektroniske struktur. Diagram over strukturen af et atom: kerne, elektronskal. Eksempler
Ethvert stof består af meget små partikler kaldet atomer . Et atom er den mindste partikel kemisk element, bevarer alle dets karakteristiske egenskaber. For at forestille sig størrelsen af et atom er det nok at sige, at hvis de kunne placeres tæt på hinanden, ville en million atomer kun optage en afstand på 0,1 mm.
Videreudvikling af videnskaben om stoffets struktur viste, at atomet også har en kompleks struktur og består af elektroner og protoner. Sådan opstod den elektroniske teori om stoffets struktur.
I oldtiden blev det opdaget, at der er to typer elektricitet: positiv og negativ. Mængden af elektricitet indeholdt i kroppen kom til at blive kaldt ladning. Afhængigt af hvilken type elektricitet en krop besidder, kan ladningen være positiv eller negativ.
Det blev også fastslået eksperimentelt, at lignende ladninger frastøder, og i modsætning til ladninger tiltrækker.
Lad os overveje atomets elektroniske struktur. Atomer er opbygget af endnu mindre partikler end dem selv, kaldet elektroner.
DEFINITION:En elektron er den mindste partikel af stof, der har den mindste negative elektriske ladning.
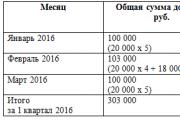
Elektroner kredser om en central kerne bestående af en eller flere protoner Og neutroner, i koncentriske baner. Elektroner er negativt ladede partikler, protoner er positivt ladede, og neutroner er neutrale (figur 1.1).
DEFINITION:En proton er den mindste partikel af stof, der har den mindste positive elektriske ladning.
Eksistensen af elektroner og protoner er uden tvivl. Forskere bestemte ikke kun massen, ladningen og størrelsen af elektroner og protoner, men fik dem endda til at arbejde i forskellige elektriske og radiotekniske enheder.
Det blev også fundet, at en elektrons masse afhænger af hastigheden af dens bevægelse, og at elektronen ikke kun bevæger sig fremad i rummet, men også roterer rundt om sin akse.
Det enkleste i opbygningen er brintatomet (fig. 1.1). Den består af en protonkerne og en elektron, der roterer med stor hastighed rundt om kernen og danner atomets ydre skal (kredsløb). Mere komplekse atomer har flere skaller, gennem hvilke elektroner roterer.
Disse skaller er fyldt med elektroner sekventielt fra kernen (figur 1.2).

Lad os nu se på det . Den yderste skal kaldes valens, og antallet af elektroner indeholdt i det kaldes valens. Jo længere fra kernen valensskal, derfor, jo mindre tiltrækningskraft oplever hver valenselektron fra kernen. Atomet øger således evnen til at binde elektroner til sig selv i tilfælde af, at valensskallen ikke er fyldt og er placeret langt fra kernen, eller at miste dem.
De ydre skalelektroner kan modtage energi. Hvis elektronerne i valensskallen modtager påkrævet niveau energi fra ydre kræfter, kan de bryde væk fra det og efterlade atomet, det vil sige blive til frie elektroner. Frie elektroner er i stand til at bevæge sig tilfældigt fra et atom til atom. De materialer, der indeholder et stort antal frie elektroner, kaldes konduktører
.
Isolatorer
, er det modsatte af konduktører. De forhindrer lækage elektrisk strøm. Isolatorer er stabile, fordi valenselektronerne fra nogle atomer fylder andre atomers valensskaller og forbinder dem. Dette forhindrer dannelsen af frie elektroner.
Indtag en mellemposition mellem isolatorer og ledere halvledere
, men vi taler om dem senere
Lad os overveje atomets egenskaber. Et atom, der har det samme antal elektroner og protoner, er elektrisk neutralt. Et atom, der får en eller flere elektroner, bliver negativt ladet og kaldes en negativ ion. Hvis et atom mister en eller flere elektroner, bliver det til en positiv ion, det vil sige, at det bliver positivt ladet.
Mendeleevs periodiske system af grundstoffer. Atomets struktur.
MENDELEVS PERIODISKE SYSTEM AF ELEMENTER - kemisk klassificering. elementer skabt af russisk. videnskabsmand D.I. Mendeleev på grundlag af den periodicitet, han opdagede (i 1869). lov.
Moderne periodisk formulering lov: grundstoffernes egenskaber (manifesteret i simple forbindelser og forbindelser) findes i periodiske perioder. afhængig af ladningen af kernerne i deres atomer.
Oplade atomkerne Z er lig med kemikaliets atomare (ordinære) nummer. element i P. s. e. M. Hvis du arrangerer alle grundstofferne i stigende rækkefølge Z. (brint H, Z = 1; helium He, Z = 2; lithium Li, Z == 3; beryllium Be, Z = 4 osv.), så danner de 7 perioder. I hver af disse perioder observeres en regelmæssig ændring i grundstoffernes egenskaber, fra periodens første grundstof (alkalimetal) til den sidste (ædelgas). Den første periode indeholder 2 elementer, den 2. og 3. - 8 elementer hver, den 4. og 5. - 18, den 6. - 32. I den 7. periode kendes 19 elementer. 2. og 3. perioder kaldes normalt små, alle efterfølgende perioder kaldes store. Hvis du arrangerer perioderne i form af vandrette rækker, så det resulterende tabellen vil vise 8 lodrette linjer. søjler; Disse er grupper af elementer, der ligner hinanden i deres egenskaber.
Egenskaberne for grundstoffer inden for grupper ændrer sig også naturligt afhængigt af stigningen i Z. For eksempel i gruppen Li - Na - K - Rb - Cs - Fr, stiger det kemiske indhold. metallets aktivitet forstærkes af arten af oxider og hydroxider.
Af teorien om atomstruktur følger det, at periodiciteten af grundstoffernes egenskaber bestemmes af lovene for dannelsen af elektronskaller omkring kernen. Når grundstoffets Z stiger, bliver atomet mere komplekst – antallet af elektroner, der omgiver kernen, stiger, og der kommer et øjeblik, hvor fyldningen af den ene elektronskal slutter, og dannelsen af den næste, ydre skal begynder. I Mendeleev-systemet falder dette sammen med begyndelsen af en ny periode. Grundstoffer med 1, 2, 3 osv. elektroner i en ny skal ligner i deres egenskaber de grundstoffer, der også havde 1, 2, 3 osv. ydre elektroner, selvom deres antal er indre. der var en (eller flere) færre elektronskaller: Na ligner Li (en ydre elektron), Mg er ligesom Be (2 ydre elektroner); A1 - til B (3 eksterne elektroner) osv. Med elementets position i P. s. e. M. er forbundet med dets kemikalie. og mange flere fysisk St.
Mange (ca. 1000) grafiske muligheder er blevet foreslået. billeder af P. s. e. M. De mest almindelige 2 varianter af P. s. e. M. - korte og lange borde; k.-l. grundlæggende forskel der er ingen mellem dem. Bilaget indeholder en af de korte tabelmuligheder. I tabellen er periodetallene angivet i første kolonne (angivet Arabiske tal 1-7). Gruppenumrene er angivet øverst med romertal I - VIII. Hver gruppe er opdelt i to undergrupper - a og b. Et sæt af elementer ledet af elementer fra små perioder, nogle gange kaldet. hovedundergrupperne er a-m og (Li står i spidsen for undergruppen alkalimetaller. F - halogener, He - inerte gasser osv.). I dette tilfælde kaldes de resterende undergrupper af elementer i store perioder. bivirkninger.
Grundstoffer med Z = 58 - 71 på grund af den særlige nærhed af strukturen af deres atomer og ligheden i deres kemi. St. udgør lanthanidfamilien, som indgår i gruppe III, men for nemheds skyld er placeret nederst på bordet. Grundstoffer med Z = 90 - 103 klassificeres ofte i aktinidfamilien af samme årsager. De efterfølges af et element med Z = 104 - curchatovy og et element med Z = 105 (se Nilsborium). I juli 1974 Ugler. fysikere rapporterede opdagelsen af et grundstof med Z = 106, og i jan. 1976 - elementer med Z = 107. Senere blev elementer med Z = 108 og 109 syntetiseret. Lavere. grænse af P. s. e. M. er kendt - det er givet af brint, da der ikke kan være et grundstof med en kerneladning mindre end én. Spørgsmålet er, hvad der er den øvre grænse for P. s. e. M., altså til hvilken ekstrem værdi kunst kan nå. syntese af elementer forbliver uløst. (Tunge kerner er ustabile, derfor findes americium med Z = 95 og efterfølgende grundstoffer ikke i naturen, men opnås i nukleare reaktioner; dog i regionen af fjernere transuranelementer, udseendet af den såkaldte. øer af stabilitet, især for Z = 114.) I art. syntese af nye grundstoffer periodisk. lov og P. s. e. M. spille en primær rolle. Mendelejevs lov og system er blandt de vigtigste generaliseringer af naturvidenskaben og danner grundlaget for moderne videnskab. lære om øens struktur.
Atomets elektroniske struktur.
Dette og de næste afsnit taler om modeller af et atoms elektronskal. Det er vigtigt at forstå det vi taler om præcis om modeller. Rigtige atomer er selvfølgelig mere komplekse, og vi ved stadig ikke alt om dem. Dog den moderne teoretiske model elektronisk struktur atom tillader en med succes at forklare og endda forudsige mange egenskaber ved kemiske elementer, derfor er det meget brugt i naturvidenskaberne.
Til at begynde med, lad os overveje mere detaljeret den "planetariske" model foreslået af N. Bohr (fig. 2-3 c).

Ris. 2-3 c. Bohrs "planetariske" model.
Den danske fysiker N. Bohr foreslog i 1913 en model af atomet, hvor elektronpartikler kredser om atomkernen på nogenlunde samme måde, som planeter kredser om Solen. Bohr foreslog, at elektroner i et atom kun kan eksistere stabilt i baner fjernet fra kernen i strengt bestemte afstande. Han kaldte disse baner stationære. Uden for stationære baner kan en elektron ikke eksistere. Hvorfor det var sådan, kunne Bohr ikke forklare på det tidspunkt. Men han viste, at en sådan model gør det muligt at forklare mange eksperimentelle fakta (dette er diskuteret mere detaljeret i afsnit 2.7).
Elektronbaner i Bohr-modellen er betegnet med heltal 1, 2, 3, ... n, startende fra den, der er tættest på kernen. I det følgende vil vi kalde sådanne baner niveauer. For at beskrive brintatomets elektroniske struktur er niveauer alene tilstrækkelige. Men i mere komplekse atomer, som det viste sig, består niveauerne af lignende energier underniveauer. For eksempel består niveau 2 af to underniveauer (2s og 2p). Det tredje niveau består af 3 underniveauer (3s, 3p og 3d), som vist i fig. 2-6. Det fjerde niveau (det passede ikke på figuren) består af underniveauer 4s, 4p, 4d, 4f. I afsnit 2.7 vil vi fortælle dig, hvor præcis disse underniveaunavne kom fra og omkring fysiske eksperimenter, som tillod os at "se" elektroniske niveauer og underniveauer i atomer.

Ris. 2-6. Bohrs model for atomer mere komplekse end hydrogenatomet. Tegningen er ikke i skala - faktisk er underniveauerne på samme niveau meget tættere på hinanden.
Der er nøjagtig lige så mange elektroner i elektronskallen af et atom, som der er protoner i dets kerne, så atomet som helhed er elektrisk neutralt. Elektroner i et atom befolker niveauerne og underniveauerne tættest på kernen, fordi deres energi i dette tilfælde er mindre, end hvis de befolkede fjernere niveauer. Hvert niveau og underniveau kan kun indeholde et vist antal elektroner.
Underniveauerne består til gengæld af lige stor energi orbitaler(de er ikke vist i fig. 2-6). Billedligt talt, hvis elektronskyen af et atom sammenlignes med en by eller gade, hvor alle elektronerne i et givet atom "lever", så kan et niveau sammenlignes med et hus, et underniveau med en lejlighed og en orbital med en plads til elektroner. Alle orbitaler på et hvilket som helst underniveau har den samme energi. På s-underniveau er der kun ét "rum" - orbitalen. p-underniveauet har 3 orbitaler, d-underniveauet har 5, og f-underniveauet har så mange som 7 orbitaler. En eller to elektroner kan "leve" i hver "rums" orbital. Forbuddet mod at elektroner har mere end to i en orbital kaldes Paulis forbud- opkaldt efter videnskabsmanden, der opdagede dette vigtig egenskab atomets struktur. Hver elektron i et atom har sin egen "adresse", som er skrevet som et sæt af fire tal kaldet "kvante". Kvantetal vil blive diskuteret i detaljer i afsnit 2.7. Her vil vi kun nævne hovedkvantetallet n(se fig. 2-6), som i elektronens "adresse" angiver nummeret på det niveau, hvor denne elektron eksisterer.
©2015-2019 websted
Alle rettigheder tilhører deres forfattere. Dette websted gør ikke krav på forfatterskab, men giver gratis brug.
Sideoprettelsesdato: 2016-08-20
Kemikalier er, hvad verden omkring os er lavet af.
Hvert kemisk stofs egenskaber er opdelt i to typer: kemisk, som karakteriserer dets evne til at danne andre stoffer, og fysisk, som er objektivt observeret og kan betragtes isoleret fra kemiske omdannelser. For eksempel er et stofs fysiske egenskaber dets aggregeringstilstand (fast, flydende eller gasformig), termisk ledningsevne, varmekapacitet, opløselighed i forskellige miljøer(vand, alkohol osv.), massefylde, farve, smag osv.
Transformationer af nogle kemiske stoffer i andre stoffer kaldes kemiske fænomener eller kemiske reaktioner. Det skal bemærkes, at der også er fysiske fænomener, som åbenlyst er ledsaget af ændringer i nogle fysiske egenskaber stoffer uden at blive omdannet til andre stoffer. TIL fysiske fænomener omfatter fx smeltning af is, frysning eller fordampning af vand osv.
Det faktum, at et kemisk fænomen opstår under enhver proces, kan konkluderes ved at observere karakteristiske træk kemiske reaktioner, såsom farveændring, sedimentation, gasudvikling, varme og/eller lys.
For eksempel kan en konklusion om forekomsten af kemiske reaktioner laves ved at observere:
Dannelse af sediment ved kogning af vand, kaldet skæl i hverdagen;
Frigivelse af varme og lys, når en ild brænder;
Ændring i farve af et snit af et frisk æble i luften;
Dannelse af gasbobler under dejgæring mv.
De mindste partikler af et stof, der stort set ikke undergår ændringer under kemiske reaktioner, men kun forbinder sig med hinanden på en ny måde, kaldes atomer.
Selve ideen om eksistensen af sådanne enheder af stof opstod tilbage i Det gamle Grækenland i de gamle filosoffers hoveder, hvilket faktisk forklarer oprindelsen af udtrykket "atom", eftersom "atomos" bogstaveligt oversat fra græsk betyder "udeleligt".
Men i modsætning til de gamle græske filosoffers idé er atomer ikke det absolutte minimum af stof, dvs. de har selv en kompleks struktur.
Hvert atom består af såkaldte subatomære partikler - protoner, neutroner og elektroner, betegnet med henholdsvis symbolerne p +, n o og e -. Overskriften i den anvendte notation indikerer, at protonen har en enhedspositiv ladning, elektronen har en enhedsnegativ ladning, og neutronen har ingen ladning.
Vedrørende kvalitetsenhed atom, så er for hvert atom alle protoner og neutroner koncentreret i den såkaldte kerne, som elektronerne danner en elektronskal omkring.
Protonen og neutronen har næsten samme masser, dvs. m p ≈ m n, og elektronens masse er næsten 2000 gange mindre end massen af hver af dem, dvs. m p/m e ≈ m n/m e ≈ 2000.
Da den grundlæggende egenskab ved et atom er dets elektriske neutralitet, og ladningen af en elektron er lig med ladningen af en proton, kan vi ud fra dette konkludere, at antallet af elektroner i et atom er lig med antallet af protoner.
For eksempel viser tabellen nedenfor den mulige sammensætning af atomer:
Type af atomer med samme kerneladning, dvs. Med samme antal protoner i deres kerner kaldes et kemisk grundstof. Ud fra tabellen ovenfor kan vi konkludere, at atom1 og atom2 tilhører et kemisk grundstof, og atom3 og atom4 tilhører et andet kemisk grundstof.
Hvert kemisk grundstof har sit eget navn og individuelle symbol, som læses på en bestemt måde. Så for eksempel kaldes det enkleste kemiske grundstof, hvis atomer kun indeholder én proton i kernen, "brint" og betegnes med symbolet "H", som læses som "aske", og et kemisk grundstof med en nuklear ladning på +7 (dvs. indeholder 7 protoner) - "nitrogen", har symbolet "N", som læses som "en".
Som du kan se fra tabellen ovenfor, kan atomer af et kemisk grundstof afvige i antallet af neutroner i deres kerner.
Atomer, der tilhører det samme kemiske grundstof, men har forskellige mængder neutroner og som en konsekvens heraf masse kaldes isotoper.
For eksempel har det kemiske grundstof brint tre isotoper - 1 H, 2 H og 3 H. Indeksene 1, 2 og 3 over symbolet H betyder det samlede antal neutroner og protoner. De der. Ved at vide, at brint er et kemisk grundstof, som er karakteriseret ved, at der er én proton i kernerne af dets atomer, kan vi konkludere, at der i 1H-isotopen slet ikke er neutroner (1-1 = 0), i 2 H isotopen - 1 neutron (2-1=1) og i 3 H isotopen – to neutroner (3-1=2). Da neutronen og protonen, som allerede nævnt, har samme masser, og elektronens masse er ubetydelig lille i sammenligning med dem, betyder det, at 2H-isotopen er næsten dobbelt så tung som 1H-isotopen, og 3 H isotop er endnu tre gange tungere. På grund af så stor en spredning i masserne af brintisotoper blev isotoperne 2 H og 3 H endda tildelt separate individuelle navne og symboler, hvilket ikke er typisk for noget andet kemisk grundstof. 2H-isotopen fik navnet deuterium og fik symbolet D, og 3H-isotopen fik navnet tritium og fik symbolet T.
Hvis vi tager massen af protonen og neutronen under ét og negligerer elektronens masse, kan det øverste venstre indeks, ud over det samlede antal protoner og neutroner i atomet, faktisk betragtes som dets masse, og derfor kaldes dette indeks for massetallet og er betegnet med symbolet A. Da ladningen af kernen i nogen protoner svarer til atomet, og ladningen af hver proton konventionelt betragtes som lig med +1, er antallet af protoner i kerne kaldes ladningsnummeret (Z). Ved at betegne antallet af neutroner i et atom som N, kan forholdet mellem massetal, ladningstal og antal neutroner udtrykkes matematisk som:
Ifølge moderne begreber har elektronen en dobbelt (partikelbølge) natur. Det har egenskaber af både en partikel og en bølge. Ligesom en partikel har en elektron masse og ladning, men samtidig er strømmen af elektroner, ligesom en bølge, karakteriseret ved evnen til diffraktion.
Til at beskrive tilstanden af en elektron i et atom bruges kvantemekanikkens begreber, hvorefter elektronen ikke har en bestemt bevægelsesbane og kan lokaliseres på ethvert punkt i rummet, men med forskellige sandsynligheder.
Området i rummet omkring kernen, hvor en elektron med størst sandsynlighed findes, kaldes en atomorbital.
En atomorbital kan have forskellige former, størrelse og orientering. En atomorbital kaldes også en elektronsky.
Grafisk betegnes en atomorbital normalt som en kvadratisk celle:
Kvantemekanik har et ekstremt komplekst matematisk apparat, og derfor overvejes der inden for rammerne af et skolekemikursus kun konsekvenserne af kvantemekanisk teori.
Ifølge disse konsekvenser er enhver atomorbital og elektronen placeret i den fuldstændig karakteriseret ved 4 kvantetal.
- Det vigtigste kvantetal, n, bestemmer den samlede energi af en elektron i en given orbital. Værdiinterval for hovedkvantetallet - alle heltal, dvs. n = 1,2,3,4, 5 osv.
- Det orbitale kvantetal - l - karakteriserer formen af det atomare orbital og kan tage en hvilken som helst heltalværdi fra 0 til n-1, hvor n, husker, er hovedkvantetallet.
Orbitaler med l = 0 kaldes s-orbitaler. s-Orbitaler er sfæriske i form og har ingen retningsbestemthed i rummet:
Orbitaler med l = 1 kaldes s-orbitaler. Disse orbitaler har form som en tredimensionel otte-figur, dvs. en form opnået ved at dreje et ottetal omkring en symmetriakse og udadtil ligner en håndvægt:
Orbitaler med l = 2 kaldes d-orbitaler, og med l = 3 – f-orbitaler. Deres struktur er meget mere kompleks.
3) Magnetisk kvantetal – m l – bestemmer den rumlige orientering af en specifik atomorbital og udtrykker projektionen af orbitals vinkelmoment på retningen magnetfelt. Det magnetiske kvantetal m l svarer til orbitalens orientering i forhold til retningen af den eksterne magnetiske feltstyrkevektor og kan tage alle heltalsværdier fra –l til +l, inklusive 0, dvs. det samlede antal mulige værdier er (2l+1). Så for eksempel for l = 0 m l = 0 (én værdi), for l = 1 m l = -1, 0, +1 (tre værdier), for l = 2 m l = -2, -1, 0, + 1, +2 (fem værdier af magnetisk kvantetal) osv.
Så for eksempel p-orbitaler, dvs. orbitaler med et orbitalt kvantetal l = 1, der har form som en "tredimensionel ottetal", svarer til tre værdier af det magnetiske kvantetal (-1, 0, +1), som igen, svarer til tre retninger vinkelret på hinanden i rummet.
4) Spin-kvantetallet (eller blot spin) - m s - kan konventionelt betragtes som ansvarlig for rotationsretningen af elektronen i atomet; det kan antage værdier. Elektroner med forskellige spins er angivet med lodrette pile, der peger ind forskellige sider: ↓ og .
Mængden af alle orbitaler i et atom, der har det samme hovedkvantetal, kaldes energiniveauet eller elektronskallen. Enhver vilkårlig energiniveau med nogle tal består n af n 2 orbitaler.
Et sæt orbitaler med de samme værdier af hovedkvantetal og orbitalkvantetal repræsenterer et energiunderniveau.
Hvert energiniveau, som svarer til det vigtigste kvantetal n, indeholder n underniveauer. Til gengæld består hvert energiunderniveau med orbitalt kvantetal l af (2l+1) orbitaler. Således består s-underniveauet af en s-orbitaler, p-underniveauet består af tre p-orbitaler, d-underniveauet består af fem d-orbitaler, og f-underniveauet består af syv f-orbitaler. Da, som allerede nævnt, én atomorbital ofte betegnes med én kvadratisk celle, kan s-, p-, d- og f-underniveauerne repræsenteres grafisk som følger:
Hver orbital svarer til et individuelt strengt defineret sæt af tre kvantetal n, l og ml.
Fordelingen af elektroner blandt orbitaler kaldes elektronkonfigurationen.
Fyldningen af atomare orbitaler med elektroner sker i overensstemmelse med tre betingelser:
- Minimum energiprincip: Elektroner fylder orbitaler med start fra det laveste energiunderniveau. Rækkefølgen af underniveauer i stigende rækkefølge af deres energier er som følger: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
For at gøre det nemmere at huske denne sekvens med udfyldning af elektroniske underniveauer, er følgende grafiske illustration meget praktisk:
- Pauli princippet: Hver orbital kan ikke indeholde mere end to elektroner.
Hvis der er én elektron i en orbital, så kaldes den uparret, og hvis der er to, så kaldes de et elektronpar.
- Hunds regel: den mest stabile tilstand af et atom er en, hvor atomet inden for ét underniveau har det maksimalt mulige antal uparrede elektroner. Denne mest stabile tilstand af atomet kaldes grundtilstanden.
Faktisk betyder ovenstående, at f.eks. placeringen af 1., 2., 3. og 4. elektroner i tre orbitaler af p-underniveauet vil blive udført som følger:
Fyldningen af atomare orbitaler fra brint, som har et ladningstal på 1, til krypton (Kr), med et ladningstal på 36, vil blive udført som følger:
En sådan repræsentation af rækkefølgen af fyldning af atomare orbitaler kaldes et energidiagram. Ud fra de elektroniske diagrammer over de enkelte elementer er det muligt at nedskrive deres såkaldte elektroniske formler (konfigurationer). Så for eksempel et grundstof med 15 protoner og som konsekvens heraf 15 elektroner, dvs. fosfor (P) vil have følgende energidiagram:
Når det omdannes til en elektronisk formel, vil fosforatomet have formen:
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
Tallene i normal størrelse til venstre for underniveausymbolet viser energiniveautallet, og overskriften til højre for underniveausymbolet viser antallet af elektroner i det tilsvarende underniveau.
Nedenfor er de elektroniske formler for de første 36 elementer i det periodiske system af D.I. Mendeleev.
| periode | Varenr. | symbol | Navn | elektronisk formel |
| jeg | 1 | H | brint | 1s 1 |
| 2 | Han | helium | 1s 2 | |
| II | 3 | Li | lithium | 1s 2 2s 1 |
| 4 | Være | beryllium | 1s 2 2s 2 | |
| 5 | B | bor | 1s 2 2s 2 2p 1 | |
| 6 | C | kulstof | 1s 2 2s 2 2p 2 | |
| 7 | N | nitrogen | 1s 2 2s 2 2p 3 | |
| 8 | O | ilt | 1s 2 2s 2 2p 4 | |
| 9 | F | fluor | 1s 2 2s 2 2p 5 | |
| 10 | Ne | neon | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | natrium | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | magnesium | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | aluminium | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | silicium | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | fosfor | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | svovl | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | klor | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | argon | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | kalium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | calcium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | Sc | skandium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | titanium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | vanadium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | krom | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 her observerer vi springet af en elektron med s på d underniveau | |
| 25 | Mn | mangan | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | jern | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | Co | kobolt | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | nikkel | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | kobber | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 her observerer vi springet af en elektron med s på d underniveau | |
| 30 | Zn | zink | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Ga | gallium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | germanium | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | Som | arsenik | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | selen | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | brom | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | krypton | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Som allerede nævnt, i deres grundtilstand, er elektroner i atomare orbitaler placeret efter princippet om mindst energi. Men i nærværelse af tomme p-orbitaler i atomets grundtilstand kan atomet ofte, ved at overføre overskydende energi til det, overføres til den såkaldte exciterede tilstand. For eksempel har et boratom i sin grundtilstand en elektronisk konfiguration og et energidiagram af følgende form:
5 B = 1s 2 2s 2 2p 1
Og i en ophidset tilstand (*), dvs. Når noget energi tildeles et boratom, vil dets elektronkonfiguration og energidiagram se sådan ud:
5 B* = 1s 2 2s 1 2p 2
Afhængigt af hvilket underniveau i atomet der fyldes sidst, opdeles kemiske grundstoffer i s, p, d eller f.
Finde s, p, d og f elementer i tabellen D.I. Mendeleev:
- S-elementerne har det sidste s-underniveau, der skal udfyldes. Disse elementer inkluderer elementer i hovedundergrupperne (til venstre i tabelcellen) i gruppe I og II.
- For p-elementer udfyldes p-underniveauet. P-elementerne omfatter de sidste seks elementer i hver periode, undtagen den første og syvende, samt elementer i hovedundergrupperne i gruppe III-VIII.
- d-elementer er placeret mellem s- og p-elementer i store perioder.
- f-elementer kaldes lanthanider og actinider. De er anført nederst i D.I.-tabellen. Mendeleev.
Da kernerne i de reagerende atomer under kemiske reaktioner forbliver uændrede (med undtagelse af radioaktive transformationer), afhænger atomernes kemiske egenskaber af strukturen af deres elektroniske skaller. Teori atomets elektroniske struktur bygget på basis af kvantemekanikkens apparat. Således kan strukturen af atomare energiniveauer opnås på grundlag af kvantemekaniske beregninger af sandsynligheden for at finde elektroner i rummet omkring atomkernen ( ris. 4.5).
Ris. 4.5. Skema til opdeling af energiniveauer i underniveauer
Det grundlæggende i teorien om et atoms elektroniske struktur er reduceret til følgende bestemmelser: tilstanden af hver elektron i et atom er karakteriseret ved fire kvantetal: hovedkvantetallet n = 1, 2, 3,; orbital (azimuthal) l=0,1,2, n-1; magnetisk m l = –l, –1,0,1, l; spin m s = -1/2, 1/2 .
Ifølge Pauli princippet, i det samme atom kan der ikke være to elektroner med det samme sæt af fire kvantetal n, l, m l , m s; samlinger af elektroner med de samme hovedkvantetal n danner elektronlag eller energiniveauer for atomet, nummereret fra kernen og betegnet som K, L, M, N, O, P, Q, og i energilaget med en given værdi n kan ikke være mere end 2n 2 elektroner. Samlinger af elektroner med samme kvantetal n Og l, form underniveauer, udpeget efterhånden som de bevæger sig væk fra kernen som s, p, d, f.
Den probabilistiske bestemmelse af elektronens position i rummet omkring atomkernen svarer til Heisenberg-usikkerhedsprincippet. Ifølge kvantemekaniske begreber har en elektron i et atom ikke en bestemt bevægelsesbane og kan være placeret i enhver del af rummet omkring kernen, og dens forskellige positioner betragtes som en elektronsky med en vis negativ ladningstæthed. Det rum omkring kernen, hvori en elektron med størst sandsynlighed findes, kaldes orbital. Den indeholder omkring 90 % af elektronskyen. Hvert underniveau 1s, 2s, 2p etc. svarer til et vist antal orbitaler af en bestemt form. For eksempel, 1s- Og 2s- orbitaler er sfæriske og 2 p-orbitaler ( 2 p x , 2 s y , 2 s z-orbitaler) er orienteret i indbyrdes vinkelrette retninger og har form som en håndvægt ( ris. 4.6).

Ris. 4.6. Form og orientering af elektronorbitaler.
Under kemiske reaktioner undergår atomkernen ikke ændringer; kun atomernes elektroniske skaller ændres, hvis struktur forklarer mange af de kemiske grundstoffers egenskaber. Baseret på teorien om atomets elektroniske struktur blev den dybe fysiske betydning af Mendeleevs periodiske lov om kemiske grundstoffer etableret, og teorien om kemisk binding blev skabt.
Den teoretiske begrundelse for det periodiske system af kemiske elementer inkluderer data om atomets struktur, hvilket bekræfter eksistensen af en forbindelse mellem periodiciteten af ændringer i kemiske elementers egenskaber og den periodiske gentagelse af lignende typer elektroniske konfigurationer af deres atomer.
I lyset af doktrinen om atomets struktur bliver Mendeleevs opdeling af alle elementer i syv perioder berettiget: Periodens nummer svarer til antallet af energiniveauer af atomer fyldt med elektroner. I små perioder, med en stigning i den positive ladning af atomkerner, stiger antallet af elektroner på det eksterne niveau (fra 1 til 2 i den første periode og fra 1 til 8 i den anden og tredje periode), hvilket forklarer ændring i elementernes egenskaber: i begyndelsen af perioden (undtagen den første) er der alkalimetal, derefter observeres en gradvis svækkelse af metalliske egenskaber og styrkelse af ikke-metalliske egenskaber. Dette mønster kan spores for elementer fra den anden periode i tabel 4.2.
Tabel 4.2.

I store perioder, når ladningen af kernerne stiger, er fyldningen af niveauer med elektroner vanskeligere, hvilket forklarer den mere komplekse ændring i grundstoffernes egenskaber sammenlignet med grundstoffer i små perioder.
Den identiske karakter af egenskaberne af kemiske grundstoffer i undergrupper forklares af den lignende struktur af det eksterne energiniveau, som vist i bord 4.3, der illustrerer rækkefølgen af fyldning af energiniveauer med elektroner for undergrupper af alkalimetaller.
Tabel 4.3.

Gruppenummeret angiver normalt antallet af elektroner i et atom, der kan deltage i dannelsen af kemiske bindinger. Dette er den fysiske betydning af gruppenummeret. På fire steder i det periodiske system er grundstofferne ikke arrangeret i rækkefølge efter stigende atommasse: Ar Og K,Co Og Ni,Te Og jeg,Th Og Pa. Disse afvigelser blev betragtet som mangler ved det periodiske system af kemiske grundstoffer. Læren om atomets struktur forklarede disse afvigelser. Eksperimentel bestemmelse af nukleare ladninger viste, at arrangementet af disse elementer svarer til en stigning i ladningen af deres kerner. Derudover gjorde den eksperimentelle bestemmelse af ladningerne af atomkerner det muligt at bestemme antallet af grundstoffer mellem brint og uran samt antallet af lanthanider. Nu er alle pladser i det periodiske system udfyldt i intervallet fra Z=1 Før Z=114 Men det periodiske system er ikke komplet, opdagelsen af nye transuranelementer er mulig.
Lad os se på, hvordan et atom er bygget. Husk, at vi udelukkende vil tale om modeller. I praksis er atomer en meget mere kompleks struktur. Men takket være moderne udvikling er vi i stand til at forklare og endda med succes forudsige egenskaber (selvom ikke alle). Så hvad er strukturen af et atom? Hvad er det lavet af?
Planetarisk model af atomet
Det blev første gang foreslået af den danske fysiker N. Bohr i 1913. Dette er den første teori om atomstruktur baseret på videnskabelige fakta. Derudover lagde det grundlaget for moderne tematisk terminologi. I den producerer elektron-partikler rotationsbevægelser omkring atomet efter samme princip som planeterne omkring Solen. Bohr foreslog, at de udelukkende kunne eksistere i baner placeret i en strengt defineret afstand fra kernen. Videnskabsmanden kunne ikke forklare, hvorfor det var sådan, fra et videnskabeligt synspunkt, men en sådan model blev bekræftet af mange eksperimenter. Heltal blev brugt til at udpege baner, begyndende med et, som var nummereret tættest på kernen. Alle disse baner kaldes også niveauer. Brintatomet har kun ét niveau, hvorpå én elektron roterer. Men komplekse atomer har også niveauer. De er opdelt i komponenter, der kombinerer elektroner med lignende energipotentiale. Så den anden har allerede to underniveauer - 2s og 2p. Den tredje har allerede tre - 3'ere, 3p og 3d. Og så videre. Først "befolkes" underniveauerne tættere på kernen og derefter de fjerne. Hver af dem kan kun indeholde et vist antal elektroner. Men dette er ikke enden. Hvert underniveau er opdelt i orbitaler. Lad os lave en sammenligning med det almindelige liv. Et atoms elektronsky kan sammenlignes med en by. Niveauer er gader. Underniveau - privat hus eller lejlighed. Orbital - værelse. Hver af dem "lever" en eller to elektroner. De har alle bestemte adresser. Dette var det første diagram over atomets struktur. Og endelig, om adresserne på elektroner: de bestemmes af sæt tal, der kaldes "kvante".
Bølgemodel af atomet

Men med tiden blev planetmodellen revideret. En anden teori om atomstruktur blev foreslået. Det er mere avanceret og giver dig mulighed for at forklare resultaterne af praktiske eksperimenter. Den første blev erstattet af atomets bølgemodel, som blev foreslået af E. Schrödinger. Da var det allerede fastslået, at en elektron kan manifestere sig ikke kun som en partikel, men også som en bølge. Hvad gjorde Schrödinger? Han anvendte en ligning, der beskriver en bølges bevægelse i Således kan man ikke finde en elektrons bane i et atom, men sandsynligheden for dens påvisning på et bestemt punkt. Det, der forener begge teorier, er, at elementarpartikler er placeret på bestemte niveauer, underniveauer og orbitaler. Det er her ligheden mellem modellerne slutter. Lad mig give dig et eksempel: i bølgeteori er en orbital et område, hvor en elektron kan findes med 95 % sandsynlighed. Resten af rummet står for 5%.Men til sidst viste det sig, at atomernes strukturelle træk er afbildet ved hjælp af bølgemodellen, på trods af at den anvendte terminologi er almindelig.
Begrebet sandsynlighed i dette tilfælde

Hvorfor blev dette udtryk brugt? Heisenberg formulerede usikkerhedsprincippet i 1927, som nu bruges til at beskrive mikropartiklers bevægelse. Det er baseret på deres grundlæggende forskel fra almindelige fysiske kroppe. Hvad er det? Klassisk mekanik antog, at en person kunne observere fænomener uden at påvirke dem (observation af himmellegemer). Baseret på de opnåede data er det muligt at beregne, hvor objektet vil være på et bestemt tidspunkt. Men i mikrokosmos er tingene nødvendigvis anderledes. Så for eksempel er det nu ikke muligt at observere en elektron uden at påvirke den på grund af det faktum, at instrumentets og partiklens energier er uforlignelige. Dette fører til ændringer i dens placering af elementarpartiklen, tilstand, retning, bevægelseshastighed og andre parametre. Og det giver ingen mening at tale om nøjagtige egenskaber. Selve usikkerhedsprincippet fortæller os, at det er umuligt at beregne den nøjagtige bane for en elektron omkring kernen. Du kan kun angive sandsynligheden for at finde en partikel i et bestemt område af rummet. Dette er det særlige ved strukturen af atomer af kemiske elementer. Men dette bør udelukkende tages i betragtning af videnskabsmænd i praktiske eksperimenter.
Atomsammensætning
Men lad os koncentrere os om hele emnet. Så ud over den velovervejede elektronskal er den anden komponent af atomet kernen. Den består af positivt ladede protoner og neutrale neutroner. Vi er alle bekendt med det periodiske system. Antallet af hvert element svarer til antallet af protoner, det indeholder. Antallet af neutroner er lig med forskellen mellem massen af et atom og dets antal protoner. Der kan være afvigelser fra denne regel. Så siger de, at en isotop af grundstoffet er til stede. Strukturen af et atom er sådan, at det er "omgivet" af en elektronskal. er normalt lig med antallet af protoner. Massen af sidstnævnte er cirka 1840 gange større end den førstnævnte og er omtrent lig med neutronens vægt. Radius af kernen er omkring 1/200.000 af atomets diameter. Den har i sig selv en sfærisk form. Dette er generelt strukturen af atomerne af kemiske elementer. På trods af forskellen i masse og egenskaber ser de nogenlunde ens ud.
Baner

Når man taler om, hvad et atomstrukturdiagram er, kan man ikke tie om dem. Så der er disse typer:
- s. De har en sfærisk form.
- s. De ligner tredimensionelle ottetaller eller en spindel.
- d og f. De har en kompleks form, som er svær at beskrive i formelt sprog.
En elektron af hver type kan findes med 95 % sandsynlighed i den tilsvarende orbital. Den præsenterede information skal behandles roligt, da det snarere er en abstrakt matematisk model end en fysisk virkelighed. Men med alt dette har den god forudsigelsesevne med hensyn til de kemiske egenskaber af atomer og endda molekyler. Jo længere et niveau er placeret fra kernen, jo flere elektroner kan der placeres på den. Således kan antallet af orbitaler beregnes ved hjælp af en speciel formel: x 2. Her er x lig med antallet af niveauer. Og da op til to elektroner kan placeres i en orbital, vil formlen for deres numeriske søgning i sidste ende se sådan ud: 2x 2.
Baner: tekniske data

Hvis vi taler om strukturen af fluoratomet, vil det have tre orbitaler. De vil alle blive fyldt. Orbitalernes energi inden for et underniveau er den samme. For at udpege dem skal du tilføje lagnummeret: 2s, 4p, 6d. Lad os vende tilbage til samtalen om strukturen af fluoratomet. Det vil have to s- og et p-underniveau. Den har ni protoner og det samme antal elektroner. Først et s-niveau. Det er to elektroner. Derefter det andet s-niveau. To elektroner mere. Og 5 udfylder p-niveauet. Dette er hans struktur. Efter at have læst følgende underoverskrift kan du selv udføre de nødvendige trin og sørge for dette. Hvis vi taler om, hvilken fluor også hører til, skal det bemærkes, at de, selvom de er i samme gruppe, er helt forskellige i deres egenskaber. Således varierer deres kogepunkt fra -188 til 309 grader Celsius. Så hvorfor var de forenet? Alt sammen takket være kemiske egenskaber. Alle halogener, og fluor i størst udstrækning, har den højeste oxidationsevne. De reagerer med metaller og kan uden problemer selvantænde ved stuetemperatur.
Hvordan fyldes baner?
Efter hvilke regler og principper er elektroner arrangeret? Vi foreslår, at du gør dig bekendt med de tre vigtigste, hvis ordlyd er blevet forenklet for bedre forståelse:
- Princippet om mindst energi. Elektroner har en tendens til at fylde orbitaler i rækkefølge efter stigende energi.
- Paulis princip. En orbital kan ikke indeholde mere end to elektroner.
- Hunds regel. Inden for ét underniveau fylder elektroner først tomme orbitaler og danner først derefter par.
Atomets struktur vil hjælpe med at udfylde det, og i dette tilfælde vil det blive mere forståeligt med hensyn til billede. Derfor, når man arbejder praktisk med konstruktion af kredsløbsdiagrammer, er det nødvendigt at holde det ved hånden.
Eksempel

For at opsummere alt, hvad der er blevet sagt inden for artiklens rammer, kan du tegne en prøve på, hvordan elektronerne i et atom er fordelt på deres niveauer, underniveauer og orbitaler (det vil sige, hvad niveauernes konfiguration er). Det kan afbildes som en formel, et energidiagram eller et lagdiagram. Der er meget gode illustrationer her, som ved omhyggelig undersøgelse hjælper med at forstå atomets struktur. Så det første niveau udfyldes først. Den har kun ét underniveau, hvor der kun er én orbital. Alle niveauer udfyldes sekventielt, begyndende med det mindste. Først inden for et underniveau placeres en elektron i hver orbital. Derefter oprettes par. Og hvis der er ledige, sker der et skift til et andet fyldeemne. Og nu kan du selv finde ud af, hvad strukturen af nitrogen- eller fluoratomet er (som blev overvejet tidligere). Det kan godt være lidt svært i starten, men du kan bruge billederne til at guide dig. For klarhedens skyld, lad os se på strukturen af nitrogenatomet. Den har 7 protoner (sammen med neutroner, der udgør kernen) og det samme antal elektroner (som udgør elektronskallen). Det første s-niveau udfyldes først. Den har 2 elektroner. Så kommer det andet s-niveau. Den har også 2 elektroner. Og de tre andre er placeret på p-niveauet, hvor hver af dem indtager en orbital.
Konklusion

Som du kan se, er atomets struktur ikke så svært et emne (hvis du nærmer dig det fra perspektivet af et skolekemikursus, selvfølgelig). Og det er ikke svært at forstå dette emne. Til sidst vil jeg gerne fortælle dig om nogle funktioner. Når vi for eksempel taler om strukturen af iltatomet, ved vi, at det har otte protoner og 8-10 neutroner. Og da alt i naturen har en tendens til at balancere, danner to iltatomer et molekyle, hvor to uparrede elektroner danner en kovalent binding. Et andet stabilt iltmolekyle, ozon (O3), dannes på lignende måde. Ved at kende strukturen af iltatomet kan du korrekt udarbejde formler for oxidative reaktioner, hvor det mest almindelige stof på Jorden deltager.