Mængden af varme modtaget fra opvarmning. Hvordan man beregner mængden af varme, termisk effekt og dannelsesvarme
I denne lektion vil vi fortsætte med at studere kroppens indre energi, og mere specifikt, måder at ændre den på. Og emnet for vores opmærksomhed denne gang vil være varmeoverførsel. Vi vil huske, hvilke typer det er opdelt i, hvad det måles i, og med hvilke forhold vi kan beregne mængden af varme, der overføres som følge af varmeudveksling, vi vil også give en definition af et legemes specifikke varmekapacitet.
Emne: Grundlæggende om termodynamik
Lektion: Mængden af varme. Specifik varme
Som vi allerede ved fra juniorklasser, og som vi huskede i den sidste lektion, er der to måder at ændre en krops indre energi på: udføre arbejde på den eller overføre en vis mængde varme til den. Vi kender allerede til den første metode fra, igen, sidste lektion, men vi talte også meget om den anden i ottende klasses forløb.
Processen med at overføre varme (mængde af varme eller energi) uden at udføre arbejde kaldes varmeveksling eller varmeoverførsel. Ifølge transmissionsmekanismer er det som bekendt opdelt i tre typer:
- Varmeledningsevne
- Konvektion
- Stråling
Som et resultat af en af disse processer overføres en vis mængde varme til kroppen, hvis værdi faktisk ændrer den indre energi. Lad os karakterisere denne mængde.
Definition. Mængde varme. Betegnelse - Q. Måleenheder - J. Når kropstemperaturen ændres (hvilket svarer til en ændring i indre energi), kan mængden af varme, der bruges på denne ændring, beregnes ved hjælp af formlen:
Her: - kropsvægt; - kroppens specifikke varmekapacitet; - ændring i kropstemperatur.
Desuden, hvis, det vil sige under afkøling, siger de, at kroppen afgav en vis mængde varme, eller en negativ mængde varme blev overført til kroppen. Hvis det vil sige opvarmning af kroppen observeres, vil mængden af overført varme selvfølgelig være positiv.
Særlig opmærksomhed skal betales til kroppens specifikke varmekapacitet.
Definition. Specifik varme- en værdi numerisk lig med den varmemængde, der skal overføres for at opvarme et kilogram af et stof med en grad. Specifik varmekapacitet er en individuel værdi for hvert enkelt stof. Derfor er dette en tabelværdi, naturligvis kendt, forudsat at vi ved, hvilken del af stoffet varme overføres til.
SI-enheden for specifik varme kan fås fra ovenstående ligning:
![]()
Dermed:
Lad os nu overveje tilfælde, hvor overførslen af en vis mængde varme fører til en ændring i et stofs aggregeringstilstand. Lad os huske, at sådanne overgange kaldes smeltning, krystallisation, fordampning og kondensation.
Når man går fra en væske til et fast stof og omvendt, beregnes varmemængden ved hjælp af formlen:
Her: - kropsvægt; - specifik fusionsvarme af et legeme (den mængde varme, der kræves for fuldstændigt at smelte et kilogram af et stof).
For at smelte en krop skal den overføre en vis mængde varme, og under kondensering frigiver kroppen selv miljø en vis mængde varme.
Når man bevæger sig fra en væske til en gasformig krop og omvendt, beregnes varmemængden med formlen:
Her: - kropsvægt; - specifik fordampningsvarme af et legeme (den mængde varme, der kræves for fuldstændigt at fordampe et kilogram af et stof).
For at fordampe en væske skal den overføre en vis mængde varme, og ved kondensering afgiver dampen selv en vis mængde varme til miljøet.
Det skal også understreges, at både smeltning med krystallisation og fordampning med kondensation foregår ved konstant temperatur (henholdsvis smelte- og kogepunkter) (fig. 1).

Ris. 1. Graf over temperaturens afhængighed (i grader Celsius) af mængden af modtaget stof ()
Separat er det værd at bemærke beregningen af mængden af varme, der frigives under forbrændingen af en vis masse brændstof:
Her: - masse af brændstof; - specifik forbrændingsvarme af brændstof (den mængde varme, der frigives under forbrændingen af et kilogram brændstof).
Der skal lægges særlig vægt på, at der ud over det faktum, at der for forskellige stoffer tages specifikke varmekapaciteter. forskellige betydninger, kan denne parameter være forskellig for det samme stof ved forskellige forhold. For eksempel skelnes der mellem forskellige specifikke varmekapaciteter for opvarmningsprocesser, der foregår ved konstant volumen () og for processer, der finder sted ved konstant tryk ().
Der er også en skelnen mellem molær varmekapacitet og blot varmekapacitet.
Definition. Molær varmekapacitet () - mængden af varme, der kræves for at opvarme et mol af et stof med en grad.
Varmekapacitet (C) - mængden af varme, der kræves for at opvarme en del af et stof med en vis masse med én grad. Sammenhæng mellem varmekapacitet og specifik varmekapacitet:
I den næste lektion vil vi se på en så vigtig lov som termodynamikkens første lov, der relaterer ændringen i indre energi til gassens arbejde og mængden af overført varme.
Bibliografi
- Myakishev G.Ya., Sinyakov A.Z. Molekylær fysik. Termodynamik. - M.: Bustard, 2010.
- Gendenshtein L.E., Dick Yu.I. Fysik 10 klasse. - M.: Ilexa, 2005.
- Kasyanov V.A. Fysik 10 klasse. - M.: Bustard, 2010.
- Ordbøger og encyklopædier om Akademiker ().
- Tt.pstu.ru ().
- Elementy.ru ().
Lektier
- Side 83: nr. 643-646. Fysik. Problembog. 10-11 klassetrin. Rymkevich A.P. - M.: Bustard, 2013. ()
- Hvordan hænger molær og specifik varmekapacitet sammen?
- Hvorfor dugger vinduesflader nogle gange til? Hvilken side af vinduerne sker det på?
- I hvilket vejr tørrer vandpytter hurtigere: roligt eller blæsende?
- *Hvad bruges den varme, som kroppen modtager under smeltning, på?
Den indre energi i en krop ændres, når der udføres arbejde eller varme overføres. I fænomenet varmeoverførsel overføres intern energi ved ledning, konvektion eller stråling.
Hver krop, når den opvarmes eller afkøles (gennem varmeoverførsel), vinder eller mister en vis mængde energi. Ud fra dette er det sædvanligt at kalde denne mængde energi for varmemængden.
Så, mængden af varme er den energi, som et legeme giver eller modtager under varmeoverførselsprocessen.
Hvor meget varme skal der til for at opvarme vandet? På simpelt eksempel du kan forstå, at opvarmning af forskellige mængder vand vil kræve forskellige mængder varme. Lad os sige, at vi tager to reagensglas med 1 liter vand og 2 liter vand. I hvilket tilfælde kræves der mere varme? I det andet, hvor der er 2 liter vand i et reagensglas. Det andet reagensglas vil tage længere tid at varme op, hvis vi opvarmer dem med samme brandkilde.
Mængden af varme afhænger således af kropsmassen. Jo større massen er, desto større mængde varme kræves der til opvarmning, og jo længere tid tager det at afkøle kroppen.
Hvad afhænger mængden af varme ellers af? Naturligvis fra forskellen i kropstemperaturer. Men det er ikke alt. Når alt kommer til alt, hvis vi forsøger at varme vand eller mælk, får vi brug for forskellig tid. Det vil sige, at det viser sig, at mængden af varme afhænger af det stof, som kroppen består af.
Som et resultat viser det sig, at mængden af varme, der er nødvendig til opvarmning eller mængden af varme, der frigives, når et legeme afkøles, afhænger af dets masse, af temperaturændringen og af typen af stof, som kroppen er af. sammensat.
Hvordan måles mængden af varme?
Bag varmeenhed det er almindeligt accepteret 1 Joule. Før fremkomsten af måleenheden for energi, betragtede forskerne mængden af varme som kalorier. Denne måleenhed forkortes normalt som "J"
Kalorie- dette er den mængde varme, der er nødvendig for at opvarme 1 gram vand med 1 grad celsius. Den forkortede form for kaloriemåling er "cal".
1 cal = 4,19 J.
Bemærk venligst, at i disse energienheder er det sædvanligt at angive næringsværdien af fødevarer i kJ og kcal.
1 kcal = 1000 cal.
1 kJ = 1000 J
1 kcal = 4190 J = 4,19 kJ
Hvad er specifik varmekapacitet
Hvert stof i naturen har sine egne egenskaber, og opvarmning af hvert enkelt stof kræver forskellig mængde energi, dvs. mængden af varme.
Et stofs specifikke varmekapacitet- dette er en mængde svarende til den mængde varme, der skal overføres til en krop med en masse på 1 kg for at opvarme den til en temperatur på 1 0 C
Specifik varmekapacitet er angivet med bogstavet c og har en måleværdi på J/kg*
For eksempel er vands specifikke varmekapacitet 4200 J/kg* 0 C. Det vil sige, det er den mængde varme, der skal overføres til 1 kg vand for at opvarme det med 1 0 C
Det skal huskes, at den specifikke varmekapacitet af stoffer i forskellige aggregeringstilstande er forskellig. Det vil sige at opvarme isen med 1 0 C vil kræve en anden mængde varme.
Hvordan man beregner mængden af varme for at opvarme en krop
For eksempel er det nødvendigt at beregne mængden af varme, der skal bruges for at opvarme 3 kg vand fra en temperatur på 15 0 C op til temperatur 85 0 C. Vi kender vands specifikke varmekapacitet, det vil sige den mængde energi, der skal til for at opvarme 1 kg vand med 1 grad. Det vil sige, at for at finde ud af mængden af varme i vores tilfælde, skal du gange vandets specifikke varmekapacitet med 3 og med det antal grader, du vil øge vandtemperaturen med. Så det er 4200*3*(85-15) = 882.000.
I parentes beregner vi det nøjagtige antal grader og trækker det oprindelige resultat fra det endelige krævede resultat
Så for at opvarme 3 kg vand fra 15 til 85 0 C, vi skal bruge 882.000 J varme.
Mængden af varme er angivet med bogstavet Q, formlen til at beregne den er som følger:
Q=c*m*(t2-t1).
Analyse og løsning af problemer
Opgave 1. Hvor meget varme skal der til for at opvarme 0,5 kg vand fra 20 til 50 0 C
Givet:
m = 0,5 kg.,
s = 4200 J/kg* 0 C,
t 1 = 20 0 C,
t2 = 50°C.
Vi bestemte den specifikke varmekapacitet ud fra tabellen.
Løsning:
2-t1).
Erstat værdierne:
Q=4200*0,5*(50-20) = 63.000 J = 63 kJ.
Svar: Q=63 kJ.
Opgave 2. Hvilken mængde varme skal der til for at opvarme en aluminiumsstang, der vejer 0,5 kg gange 85 0 C?
Givet:
m = 0,5 kg.,
s = 920 J/kg* 0 C,
t 1 = 0 0 C,
t2 = 85°C.
Løsning:
varmemængden bestemmes af formlen Q=c*m*(t 2-t1).
Erstat værdierne:
Q=920*0,5*(85-0) = 39.100 J = 39,1 kJ.
Svar: Q = 39,1 kJ.
730. Hvorfor bruges vand til at afkøle nogle mekanismer?
Vand har stor specifik varmekapacitet, hvilket fremmer god varmefjernelse fra mekanismen.
731. I hvilket tilfælde er det nødvendigt at bruge mere energi: at opvarme en liter vand med 1 °C eller at opvarme hundrede gram vand med 1 °C?
For at opvarme en liter vand, jo større masse, jo mere energi skal der bruges.
732. Kobbernikkelsølv og sølvgafler af lige masse blev sænket ned i varmt vand. Vil de modtage den samme mængde varme fra vandet?
En cupronickel gaffel vil modtage mere varme, fordi den specifikke varme af cupronickel er større end den for sølv.
733. Et stykke bly og et stykke støbejern af samme masse blev slået tre gange med en forhammer. Hvilket stykke blev varmere?
Bly vil opvarme mere, fordi dets specifikke varmekapacitet er lavere end støbejern, og det kræver mindre energi at opvarme blyet.
734. Den ene kolbe indeholder vand, den anden indeholder petroleum af samme masse og temperatur. En lige så opvarmet jernterning blev droppet i hver kolbe. Hvad vil varme op til en højere temperatur - vand eller petroleum?
Petroleum.
735. Hvorfor er temperaturudsving om vinteren og sommeren mindre skarpe i byer ved kysten end i byer beliggende inde i landet?
Vand opvarmes og afkøles langsommere end luft. Om vinteren køler det og flytter varme luftmasser ind på land, hvilket gør klimaet ved kysten varmere.
736. Den specifikke varmekapacitet af aluminium er 920 J/kg °C. Hvad betyder det?
Det betyder, at for at opvarme 1 kg aluminium med 1 °C er det nødvendigt at bruge 920 J.
737. Aluminium- og kobberstænger af samme masse 1 kg afkøles med 1 °C. Hvor meget vil den indre energi i hver blok ændre sig? For hvilken bar vil det ændre sig mere og med hvor meget?
738. Hvor meget varme skal der til for at opvarme et kilogram jernemne med 45 °C?
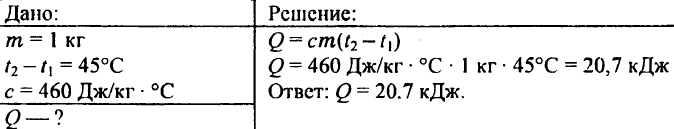
739. Hvor meget varme skal der til for at opvarme 0,25 kg vand fra 30 °C til 50 °C?

740. Hvordan vil den indre energi i to liter vand ændre sig, når den opvarmes med 5 °C?

741. Hvor meget varme skal der til for at opvarme 5 g vand fra 20 °C til 30 °C?

742. Hvor meget varme skal der til for at opvarme en aluminiumskugle, der vejer 0,03 kg, med 72 °C?

743. Beregn mængden af varme, der kræves for at opvarme 15 kg kobber med 80 °C.

744. Beregn den mængde varme, der kræves for at opvarme 5 kg kobber fra 10 °C til 200 °C.

745. Hvor meget varme skal der til for at opvarme 0,2 kg vand fra 15 °C til 20 °C?

746. Vand på 0,3 kg er afkølet med 20 °C. Hvor meget er vandets indre energi faldet?

747. Hvor meget varme skal der til for at opvarme 0,4 kg vand ved en temperatur på 20 °C til en temperatur på 30 °C?

748. Hvor meget varme bruges der til at opvarme 2,5 kg vand med 20 °C?

749. Hvilken mængde varme blev frigivet, når 250 g vand afkøledes fra 90 °C til 40 °C?
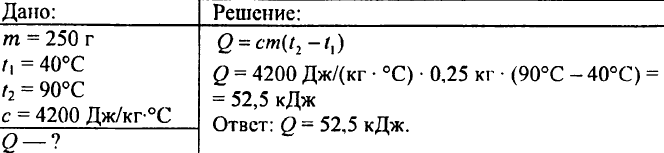
750. Hvor meget varme skal der til for at opvarme 0,015 liter vand med 1 °C?

751. Beregn mængden af varme, der kræves for at opvarme en dam med et volumen på 300 m3 gange 10 °C?
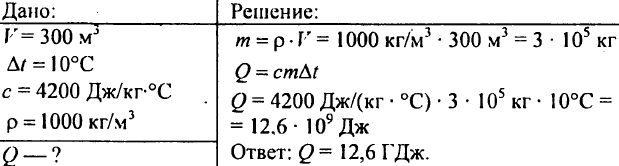
752. Hvilken mængde varme skal tilsættes 1 kg vand for at øge dets temperatur fra 30 °C til 40 °C?

753. Vand med en volumen på 10 liter er afkølet fra en temperatur på 100 °C til en temperatur på 40 °C. Hvor meget varme blev frigivet under dette?

754. Beregn mængden af varme, der kræves for at opvarme 1 m3 sand med 60 °C.

755. Luftmængde 60 m3, specifik varmekapacitet 1000 J/kg °C, luftdensitet 1,29 kg/m3. Hvor meget varme skal der til for at hæve den til 22°C?
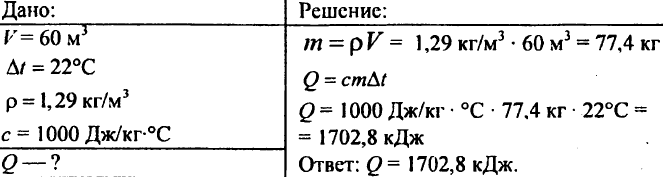
756. Vand blev opvarmet med 10 °C, hvilket forbrugte 4,20 103 J varme. Bestem mængden af vand.

757. 20,95 kJ varme blev givet til vand, der vejede 0,5 kg. Hvad blev vandtemperaturen, hvis den oprindelige vandtemperatur var 20 °C?

758. En kobbergryde på 2,5 kg fyldes med 8 kg vand ved 10 °C. Hvor meget varme skal der til for at varme vandet i gryden op til kog?

759. En liter vand ved en temperatur på 15 °C hældes i en kobberske, der vejer 300 g. Hvor meget varme skal der til for at opvarme vandet i skeen til 85 °C?

760. Et stykke opvarmet granit på 3 kg lægges i vand. Granit overfører 12,6 kJ varme til vand og afkøles med 10 °C. Hvad er stenens specifikke varmekapacitet?

761. Varmt vand ved 50 °C blev tilsat til 5 kg vand ved 12 °C, hvilket gav en blanding med en temperatur på 30 °C. Hvor meget vand tilsatte du?

762. Vand ved 20 °C blev tilsat til 3 liter vand ved 60 °C, hvilket gav vand ved 40 °C. Hvor meget vand tilsatte du?

763. Hvad bliver temperaturen på blandingen, hvis man blander 600 g vand ved 80 °C med 200 g vand ved 20 °C?

764. En liter vand ved 90 °C blev hældt i vand ved 10 °C, og vandtemperaturen blev 60 °C. Hvor mange var koldt vand?

765. Bestem, hvor meget der skal hældes i beholderen varmt vand, opvarmet til 60 °C, hvis beholderen allerede indeholder 20 liter koldt vand ved en temperatur på 15 °C; blandingens temperatur skal være 40 °C.
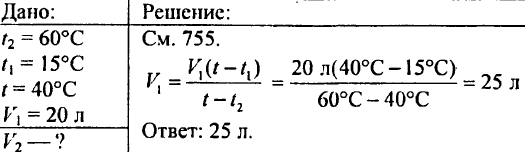
766. Bestem, hvor meget varme der kræves for at opvarme 425 g vand med 20 °C.

767. Hvor mange grader varmes 5 kg vand op, hvis vandet får 167,2 kJ?

768. Hvor meget varme skal der til for at opvarme m gram vand ved temperatur t1 til temperatur t2?
769. 2 kg vand hældes i et kalorimeter ved en temperatur på 15 °C. Til hvilken temperatur vil kalorimetervandet varmes op, hvis en 500 g messingvægt opvarmet til 100 °C sænkes ned i det? Den specifikke varmekapacitet for messing er 0,37 kJ/(kg °C).

770. Der er stykker kobber, tin og aluminium af samme volumen. Hvilken af disse stykker har den største og hvilken har den mindste varmekapacitet?

771. 450 g vand, hvis temperatur var 20 °C, blev hældt i kalorimeteret. Når 200 g jernspåner opvarmet til 100 °C blev nedsænket i dette vand, blev vandtemperaturen 24 °C. Bestem den specifikke varmekapacitet af savsmuld.

772. Et kobberkalorimeter, der vejer 100 g, rummer 738 g vand, hvis temperatur er 15 °C. 200 g kobber blev sænket ned i dette kalorimeter ved en temperatur på 100 °C, hvorefter temperaturen på kalorimeteret steg til 17 °C. Hvad er den specifikke varmekapacitet af kobber?

773. En stålkugle på 10 g tages ud af ovnen og anbringes i vand ved en temperatur på 10 °C. Vandtemperaturen steg til 25 °C. Hvad var temperaturen på kuglen i ovnen, hvis vandmassen var 50 g? Stålets specifikke varmekapacitet er 0,5 kJ/(kg °C).

777. 50 g vand ved 19 °C blev hældt i vand med en vægt på 150 g ved en temperatur på 35 °C. Hvad er temperaturen på blandingen?

778. Vand med en vægt på 5 kg ved 90 °C blev hældt i en støbejernsgryde med en vægt på 2 kg ved en temperatur på 10 °C. Hvad var temperaturen på vandet?

779. En stålskærer på 2 kg blev opvarmet til en temperatur på 800 °C og derefter sænket ned i en beholder indeholdende 15 liter vand ved en temperatur på 10 °C. Til hvilken temperatur vil vandet i beholderen varmes op?

(Indikation: For at løse dette problem er det nødvendigt at lave en ligning, hvor den ukendte temperatur af vandet i beholderen efter sænkning af kutteren tages som den ukendte.)
780. Hvilken temperatur får vandet, hvis man blander 0,02 kg vand ved 15 °C, 0,03 kg vand ved 25 °C og 0,01 kg vand ved 60 °C?
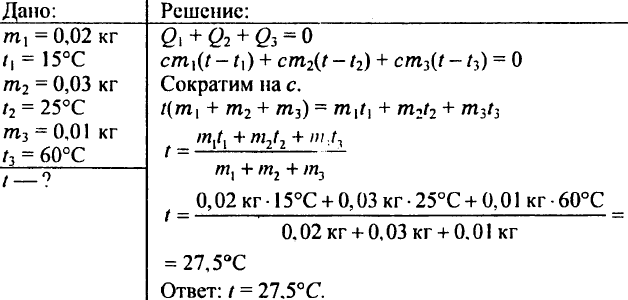
781. Til opvarmning af en velventileret klasse er den nødvendige varmemængde 4,19 MJ i timen. Vand kommer ind i radiatorerne ved 80 °C og forlader dem ved 72 °C. Hvor meget vand skal der tilføres radiatorerne hver time?

782. Bly med en vægt på 0,1 kg ved en temperatur på 100 °C blev nedsænket i et aluminiumkalorimeter, der vejede 0,04 kg, indeholdende 0,24 kg vand ved en temperatur på 15 °C. Hvorefter temperaturen i kalorimeteret nåede 16 °C. Hvad er den specifikke varme af bly?

Du kan ændre den indre energi af gassen i cylinderen, ikke kun ved at udføre arbejde, men også ved at opvarme gassen (fig. 43). Hvis du fikserer stemplet, vil gassens volumen ikke ændre sig, men temperaturen, og derfor den indre energi, vil stige.
Processen med at overføre energi fra en krop til en anden uden at udføre arbejde kaldes varmeveksling eller varmeoverførsel.
Den energi, der overføres til kroppen som følge af varmeveksling, kaldes mængden af varme. Mængden af varme kaldes også den energi, som et legeme afgiver under varmevekslingen.
Molekylært billede af varmeoverførsel. Under varmeudveksling ved grænsen mellem legemer opstår interaktionen mellem langsomt bevægende molekyler i et koldt legeme med hurtigere bevægelige molekyler i et varmt legeme. Som et resultat, kinetiske energier
molekyler justeres, og hastighederne af molekyler i en kold krop stiger, og hastighederne for en varm krop falder.
Under varmeveksling omdannes energi ikke fra en form til en anden: en del af den indre energi i det varme legeme overføres til det kolde legeme.
Mængde af varme og varmekapacitet. Fra VII-klassens fysikkursus er det kendt, at for at opvarme et masselegeme fra temperatur til temperatur er det nødvendigt at fortælle det mængden af varme
![]()
Når en krop afkøles, er dens sluttemperatur mindre end den oprindelige, og mængden af varme, som kroppen afgiver, er negativ.
Koefficienten c i formel (4.5) kaldes specifik varmekapacitet. Specifik varmekapacitet er den mængde varme, som 1 kg af et stof modtager eller afgiver, når dets temperatur ændres med 1 K-
Specifik varmekapacitet er udtrykt i joule divideret med kilogram ganget med kelvin. Forskellige legemer kræver forskellige mængder energi for at øge temperaturen med I K. Vands og kobbers specifikke varmekapacitet er således
Specifik varmekapacitet afhænger ikke kun af stoffets egenskaber, men også af den proces, varmeoverførslen sker i. Opvarmer man en gas ved konstant tryk, vil den udvide sig og udføre arbejde. For at opvarme en gas med 1 °C ved konstant tryk, skal der overføres mere varme til den end at opvarme den ved konstant volumen.
Flydende og faste legemer udvider sig lidt, når de opvarmes, og deres specifikke varmekapaciteter ved konstant volumen og konstant tryk afviger lidt.
Specifik fordampningsvarme. For at omdanne en væske til damp skal en vis mængde varme overføres til den. Væskens temperatur ændres ikke under denne transformation. Omdannelsen af en væske til damp ved en konstant temperatur fører ikke til en stigning i den kinetiske energi af molekyler, men er ledsaget af en stigning i deres potentiel energi. Den gennemsnitlige afstand mellem gasmolekyler er trods alt mange gange større end mellem væskemolekyler. Hertil kommer stigningen i volumen under overgangen af et stof fra flydende tilstand i gasform kræver, at der arbejdes mod kræfterne fra ydre tryk.
Mængden af varme, der kræves for at omdanne 1 kg væske til damp ved en konstant temperatur, kaldes
specifik varme fordampning. Denne mængde er angivet med et bogstav og udtrykt i joule pr. kilogram
Vands specifikke fordampningsvarme er meget høj: ved en temperatur på 100°C. For andre væsker (alkohol, ether, kviksølv, petroleum osv.) er den specifikke fordampningsvarme 3-10 gange mindre.
For at omdanne en flydende masse til damp kræves der en mængde varme svarende til:
Når damp kondenserer, frigives den samme mængde varme:
Specifik fusionsvarme. Når et krystallinsk legeme smelter, går al den varme, der tilføres til det, til at øge molekylernes potentielle energi. Molekylernes kinetiske energi ændres ikke, da smeltning sker ved en konstant temperatur.
Den mængde varme A, der kræves for at omdanne 1 kg af et krystallinsk stof ved smeltepunktet til en væske med samme temperatur, kaldes den specifikke smeltevarme.
Når 1 kg stof krystalliserer, frigives nøjagtig samme mængde varme. Den specifikke fusionsvarme af is er ret høj:
For at smelte et krystallinsk masselegeme kræves en mængde varme svarende til:
Mængden af varme frigivet under krystallisation af et legeme er lig med:
1. Hvad hedder mængden af varme? 2. Hvad afhænger stoffers specifikke varmekapacitet af? 3. Hvad kaldes den specifikke fordampningsvarme? 4. Hvad kaldes den specifikke fusionsvarme? 5. I hvilke tilfælde er mængden af overført varme negativ?
Den indre energi i en krop kan ændre sig på grund af arbejde ydre kræfter. For at karakterisere ændringen i indre energi under varmeoverførsel indføres en mængde kaldet varmemængden og betegnet Q.
I internationalt system Enheden for varme, såvel som arbejde og energi, er joule: = = = 1 J.
I praksis bruges nogle gange en ikke-systemisk enhed af varmemængde - kalorien. 1 cal. = 4,2 J.
Det skal bemærkes, at udtrykket "varmemængde" er uheldigt. Det blev introduceret på et tidspunkt, hvor man troede, at kroppe indeholdt noget vægtløs, undvigende væske - kalorie. Processen med varmeveksling består angiveligt i det faktum, at kalorieindhold, der strømmer fra en krop til en anden, bærer en vis mængde varme med sig. Nu, ved at kende det grundlæggende i den molekylær-kinetiske teori om strukturen af stof, forstår vi, at der ikke er nogen kalorie i kroppen, mekanismen til at ændre den indre energi i en krop er anderledes. Traditionens magt er dog stor, og vi fortsætter med at bruge et begreb, der er introduceret på baggrund af forkerte forestillinger om varmens natur. På samme tid, når man forstår karakteren af varmeoverførsel, bør man ikke fuldstændig ignorere misforståelser om det. Tværtimod, ved at tegne en analogi mellem strømmen af varme og strømmen af en hypotetisk væske af kalorie, mængden af varme og mængden af kalorie, når man løser visse klasser af problemer, er det muligt at visualisere de igangværende processer og korrekt løse problemerne. I sidste ende blev de korrekte ligninger, der beskriver varmeoverførselsprocesser, engang opnået på grundlag af forkerte ideer om kalorieindhold som varmebærer.
Lad os overveje mere detaljeret de processer, der kan opstå som følge af varmeveksling.
Hæld lidt vand i reagensglasset og luk det med en prop. Vi hænger reagensglasset fra en stang fastgjort i et stativ og placerer det under det åben ild. Reagensglasset modtager en vis mængde varme fra flammen, og temperaturen på væsken i det stiger. Når temperaturen stiger, stiger væskens indre energi. En intensiv fordampningsproces finder sted. Ekspanderende væskedampe gør mekanisk arbejde ved at skubbe en prop ud af et reagensglas.
Lad os udføre endnu et eksperiment med en model af en kanon lavet af et stykke messingrør, som er monteret på en vogn. På den ene side er røret tæt lukket med en ebonitprop, hvorigennem en stift føres. Ledninger loddes til stiften og røret, der ender i terminaler, hvortil der kan tilføres spænding fra belysningsnettet. Kanonmodellen er således en type el-kedel.
 |
Hæld lidt vand i kanonløbet og luk røret med en gummiprop. Lad os forbinde pistolen til en strømkilde. Elektricitet, der passerer gennem vand, opvarmer det. Vandet koger, hvilket fører til intens dampdannelse. Trykket af vanddamp stiger, og endelig gør de arbejdet med at skubbe proppen ud af pistolløbet.
Pistolen ruller på grund af rekyl væk i den modsatte retning af proppens udkast.
Begge oplevelser er forenet af følgende omstændigheder. Under opvarmningsprocessen af væsken forskellige veje, temperaturen af væsken og følgelig dens indre energi steg. For at væsken kunne koge og fordampe intensivt, var det nødvendigt at fortsætte opvarmningen.
Flydende dampe udførte på grund af deres indre energi mekanisk arbejde.
 |
Vi undersøger afhængigheden af mængden af varme, der kræves for at opvarme et legeme af dets masse, temperaturændringer og typen af stof. For at studere disse afhængigheder vil vi bruge vand og olie. (Til at måle temperatur i forsøget anvendes et elektrisk termometer lavet af et termoelement forbundet med et spejlgalvanometer. Termoelementets ene forbindelse sænkes ned i en beholder med koldt vand for at sikre, at dens temperatur forbliver konstant. Termoelementets anden forbindelse måler temperaturen på den væske, der testes).
Oplevelsen består af tre serier. Den første episode udforsker for konstant masse af en specifik væske (i vores tilfælde vand) afhængigheden af den mængde varme, der kræves for at opvarme den, på temperaturændringer. Vi vil bedømme mængden af varme modtaget af væsken fra varmeren (elektrisk komfur) ud fra opvarmningstiden, forudsat at der er en direkte sammenhæng mellem dem proportional afhængighed. For at resultatet af forsøget svarer til denne antagelse, er det nødvendigt at sikre en stationær varmestrøm fra den elektriske komfur til den opvarmede krop. For at gøre dette blev den elektriske komfur tændt på forhånd, så temperaturen på dens overflade ville holde op med at ændre sig ved begyndelsen af eksperimentet. For at opvarme væsken mere jævnt under eksperimentet, vil vi røre den ved hjælp af selve termoelementet. Vi vil registrere termometeraflæsningerne med jævne mellemrum, indtil lyspletten når kanten af skalaen.
Lad os konkludere: der er et direkte proportionalt forhold mellem mængden af varme, der kræves for at opvarme et legeme og ændringen i dets temperatur.
I den anden række af eksperimenter vil vi sammenligne de mængder varme, der kræves for at opvarme identiske væsker forskellige vægte når deres temperatur ændres med samme mængde.
For at gøre det lettere at sammenligne de opnåede værdier, vil vandmassen til det andet eksperiment blive taget til at være to gange mindre end i det første eksperiment.
Vi vil igen registrere termometeraflæsningerne med jævne mellemrum.
Ved at sammenligne resultaterne af det første og andet forsøg kan følgende konklusioner drages.
I den tredje række af eksperimenter vil vi sammenligne de mængder varme, der kræves for at opvarme lige store masser af forskellige væsker, når deres temperatur ændres med samme mængde.
Vi opvarmer olie på et elektrisk komfur, hvis masse er lig med massen af vand i det første eksperiment. Vi registrerer termometeraflæsningerne med jævne mellemrum.
Resultatet af eksperimentet bekræfter konklusionen om, at mængden af varme, der kræves for at opvarme et legeme, er direkte proportional med ændringen i dets temperatur og angiver desuden afhængigheden af denne varmemængde af typen af stof.
Da man i forsøget brugte olie, hvis massefylde er mindre end vands massefylde, og opvarmning af olien til en bestemt temperatur krævede mindre varme end opvarmning af vand, kan det antages, at mængden af varme, der kræves for at opvarme et legeme, afhænger af dets massefylde.
For at teste denne antagelse vil vi samtidig opvarme lige store masser af vand, paraffin og kobber på en konstant effektvarmer.
Efter samme tid er temperaturen af kobber cirka 10 gange, og paraffin cirka 2 gange højere end temperaturen af vand.
Men kobber har en højere densitet og paraffin har en lavere densitet end vand.
Erfaring viser, at den mængde, der kendetegner hastigheden af ændring i temperatur af de stoffer, hvoraf de legemer, der er involveret i varmevekslingen er lavet, ikke er densitet. Denne mængde kaldes et stofs specifikke varmekapacitet og betegnes med bogstavet c.
 |
For at sammenligne specifikke varmekapaciteter forskellige stoffer tjener speciel enhed. Enheden består af stativer, hvori en tynd paraffinplade og en strimmel med stænger ført igennem den er fastgjort. Aluminium-, stål- og messingcylindre af samme masse er fastgjort i enderne af stængerne.
Lad os opvarme cylindrene til samme temperatur ved at nedsænke dem i en beholder med vand stående på et varmt komfur. Vi fastgør de varme cylindre til stativerne og frigør dem fra fastgørelsen. Cylindrene rører samtidig paraffinpladen og begynder at synke ned i den, når paraffinen smeltes. Dybden af nedsænkning af cylindre med samme masse i en paraffinplade, når deres temperatur ændres med samme mængde, viser sig at være anderledes.
Erfaringen viser, at de specifikke varmekapaciteter af aluminium, stål og messing er forskellige.
Efter at have udført passende forsøg med smeltning faste stoffer, fordampning af væsker, forbrænding af brændstof opnår vi følgende kvantitative afhængigheder.
For at opnå enheder med specifikke mængder skal de udtrykkes fra de tilsvarende formler og i de resulterende udtryk erstatte varmeenheder - 1 J, masse - 1 kg og for specifik varmekapacitet - 1 K.
Vi får følgende enheder: specifik varmekapacitet – 1 J/kg·K, andre specifikke varme: 1 J/kg.














